Углеводный обмен. Глюкоза наряду с жирами и белками является источником энергии в организме. Запасы энергии в организме в виде гликогена (углеводы) невелики по сравнению с запасом энергии, представленной в виде жиров. Так, количество гликогена в организме человека весом 70 кг составляет 480 г (400 г – гликоген мышц и 80 г – гликоген печени), что эквивалентно 1920 ккал (320 ккал-гликоген печени и 1600 – гликоген мышц). Количество циркулирующей глюкозы в крови составляет всего 20 г (80 ккал).
В организме человека и животных глюкоза, абсорбированная в желудочно-кишечном тракте, поступает по системе воротной вены в печень. Транспорт глюкозы через слизистую оболочку кишечника осуществляется с помощью белкового натрий-глюкозного транспортера или симпортера, который имеет молекулярную массу 55 кДа, включает в себя 664 аминокислоты и ген, кодирующий этот белок-транспортер, локализуется на 22-й хромосоме. Связывание ионов натрия и глюкозы уравновешивается соответствующими конформационными изменениями внутренней поверхности мембраны, где количество связанных ионов натрия небольшое, и глюкоза высвобождается за счет уменьшения аффинности белков к глюкозе даже в том случае, если ее концентрация в межклеточной жидкости относительно высокая. Поступившая из кишечника глюкоза далее превращается в гликоген-полимер глюкозы, молекулярная масса которого исчисляется несколькими сотнями тысяч, тогда как молекулярная масса глюкоза равна 180 кДа.
Гликоген мышц представляет собой скопления, состоящие из отдельных частичек с молекулярной массой 2.107. В печени содержатся как отдельные, так и агрегированные частицы гликогена, их общая масса более 109, в отдельных частицах на 1 г полисахарида приходится 1,1 г воды. Кроме того, в них определяются ферменты, необходимые для синтеза и распада гликогена. Гликоген выявляется почти во всех тканях, но в основном он сохраняется, как указано выше, в качестве депо энергии в печени и мышцах. Количество его в печени подвержено большим колебаниям и зависит от диеты, а содержание гликогена в мышцах находится в прямой зависимости от физической активности индивидуума. В печени человека содержится около 400 ммоль (65 г) глюкозы на 1 кг ткани, в скелетных мышцах-85 ммоль (14 г) на 1 кг массы мышц. Это количество практически не изменяется при голодании, ночью или после приема пищи, богатой углеводами, но снижается до 1 ммоль на 1 кг после работы в течение 1-2 часов. Несмотря на то, что мышцы содержат меньше гликогена на 1кг массы ткани по сравнению с печенью, основное депо гликогена в организме находится в мышцах. У мужчины массой тела 70 кг на долю мышц приходится 28 кг, печени – всего 1,6 кг, следовательно, в печени содержится 0,6 моль, а в мышцах – 2,4 моль глюкозы.
Содержащаяся в этих двух депо глюкоза является основным и почти единственным источником питания инсулиннезависимых тканей. Так, головной мозг массой 1400 г при интенсивности кровоснабжения 60 мл/100 г в минуту потребляет 80 мг/мин глюкозы, т.е. около 115 г за 24 часа. Печень способна генерировать глюкозу со скоростью 130 мг/мин. Таким образом, более 60% глюкозы, образующейся в печени, идет на обеспечение нормальной активности центральной нервной системы, причем это количество остается неизменным не только при гипергликемии, но даже при диабетической коме. Потребление глюкозы ЦНС уменьшается лишь после того, как ее уровень в крови становится ниже 1,65 ммоль/л (30 мг%).
В синтезе одной молекулы гликогена участвуют от 2000 до 20 000 молекул глюкозы. Образование гликогена из глюкозы начинается с процесса фосфорилирования ее с помощью ферментов глюкокиназы (в печени) и гексокиназы (в других тканях) с образованием глюкозо-6-фосфата (Г-6-Ф), последующей его конверсией под влиянием фосфоглюкомутазы в глюкозо-1-фосфат (Г-1-Ф) и затем в уридиндифосфоглюкозу (УДФГ). УДФГ является донатором остатков глюкозы, которые под влиянием гликогенсинтетазы присоединяются к концевым остаткам гликогена; далее с помощью ферментов полимеризации образуются длинные цепочечные “ветвистые” (имеющие боковые цепи) структуры гликогена. Конверсия Г-6-Ф в Г-1-Ф и обратная реакция контролируются фосфоглюкомутазой. Образование УДФГ происходит при участии УДФГ-пирофосфорилазы, гликогена в присутствии гликогенсинтетазы (УДФГ-трансферазы), а ветвистой структуры гликогена – под влиянием фермента, действующего на боковые цепи гликогена (a-1, 4 гликан; a-1, 4 гликан-6-гликозилтрансфераза или a-гликангликозил-4, 6-трансфераза). Гликозил-4, 6-трансфераза катализирует процесс перемещения сегмента амилазы, состоящего из 7 или 11 остатков, от одной боковой цепи к другой. Вновь образовавшаяся боковая цепь гликогена обычно состоит из 7 остатков глюкозы; 1, 6-гликозиды содержат энергию, равную 4800 Дж/моль (1 ккал=4, 3 кДж). Процесс синтеза гликогена носит название гликогеногенеза. Концентрация гликогена в печени быстро повышается после приема большого количества пищи.
Распад гликогена носит название гликогенолиза. При этом высвобождаются глюкоза в виде Г-1-Ф и одна молекула глюкозы из каждой 1, 6 боковой цепи. Первичной является реакция фосфорилирования 1, 4 мостиков каждой боковой цепи с участием основного фермента – фосфорилазы, в результате чего происходит укорочение цепи на один остаток глюкозы, отщепляющийся в виде Г-1-Ф. Эта реакция обратима, однако для последующего распада гликогена требуется участие второго фермента – амило-1, 6-гликозидазы, в составе которого имеется глизил-4, 4-трансферазная активность, способствующая отщеплению 3 остатков и создающая условия для последующего действия фосфорилазы в области связывания 1, 4 остатков глюкозы. Наряду с этим амило-1,6-гликозидаза катализирует вторую реакцию гликогена, действуя на область связывания 1, 6 с высвобождением свободной глюкозы.
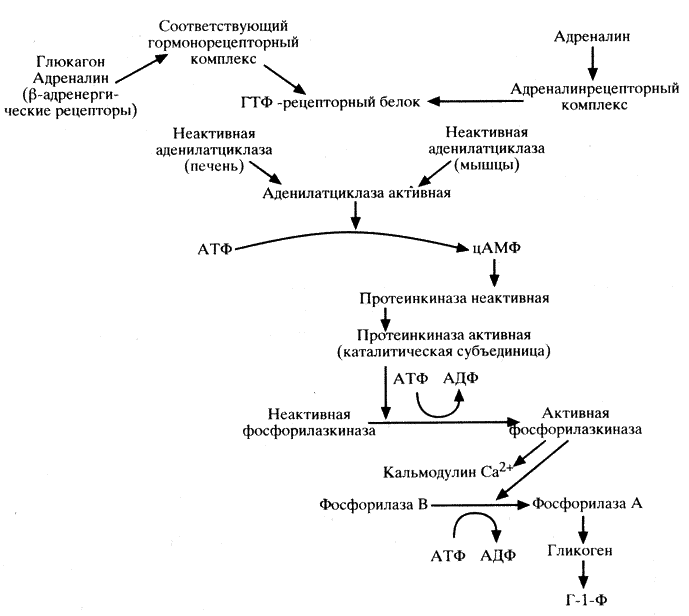
Таким образом, фосфорилаза является основным ферментом, осуществляющим контроль скорости высвобождения глюкозы. Активирование фосфорилазы довольно сложный процесс (схема 4). Активированная фосфорилаза А высвобождает из гликогена Г-1-Ф, который под действием фосфоглюкомутазы превращается в Г-6-Ф. Оба монофосфата после дефосфорилирования (соответственно ферментами глюкозо-1-фосфатазой и глюкозо-6-фосфатазой) трансформируются в глюкозу. Кроме того, глюкоза, как было указано выше, образуется непосредственно из гликогена с помощью ферментов, отщепляющих боковые цепи гликогена (амило-1,6-гликозидазы).

Окисление Г-6-Ф осуществляется гликолитическим путем (цикл Эмбдена-Меергофа) в анаэробных условиях (схема 5). Гликолитический цикл обмена глюкозы заканчивается образованием пировиноградной кислоты, которая затем конвертируется в молочную кислоту. В присутствии кислорода в митохондриях пируват декарбоксилируется в ацетил-КоА. Это превращение контролируется ферментом пируватдегидрогеназой, активность которого угнетается ацетил-КоА (конкурентно с КоА). Таким образом, в регуляции активности пируватдегидрогеназы большое значение имеет количественное содержание жирных кислот и кетоновых тел, при окислении которых количественное соотношение ацетил-КоА и КоА изменяется в пользу первого.
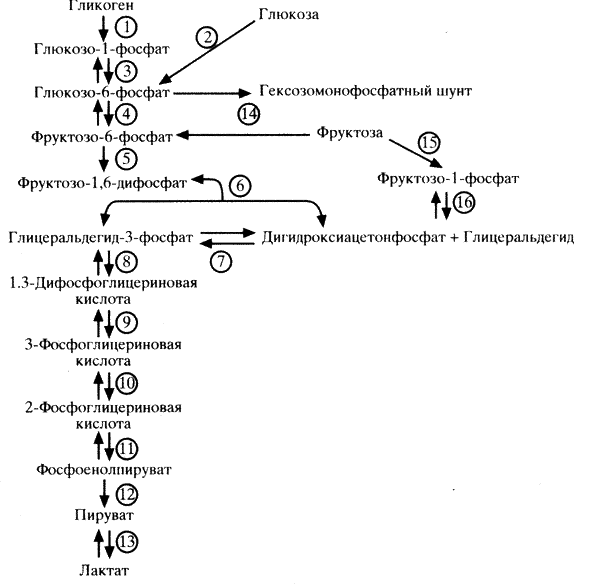
1 – фосфорилаза; 2 – гексокиназа; 3 – фосфоглюкомутаза; 4 – гексофосфатизомераза; 5 – фосфофруктокиназа; 6 – альдолаза; 7 – трифосфат изомераза; 8 – глицеральдегидфосфатдегидрогеназа; 9 – фосфоглицераткиназа; 10 – фосфоглицеромутаза; 11 – енолаза; 12 – пируваткиназа; 13 – лактатдегидрогеназа; 14 – гексокиназа; 15 – кетогексокиназа; 16 – кетозо-1-фосфатальдолаза.
Обмен фруктозы также осуществляется гликолитическим путем. Часть фруктозы превращается в глюкозу, другая часть под влиянием кетогексокиназы превращается во фруктозо-1-фосфат и далее в дигидроксиацетонфосфат, дальнейшие изменения которого происходят в гликолитическом цикле.
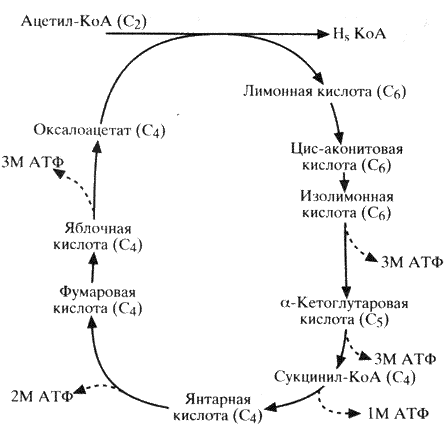
Образовавшийся в результате гликолиза в цикле Эмбдена-Меергофа ацетил-КоА (продукт окислительного декарбоксилирования пирувата) окисляется до воды и углекислого газа в цикле Кребса (лимоннокислый цикл). Этот процесс осуществляется последовательными ферментативными реакциями, в результате которых высвобождается энергия (схема 6). Полный распад одной молекулы глюкозы дает 38 молекул АТФ, причем 24 из них образуются в цикле Кребса. Ферменты этого цикла локализуются в матриксе митохондрий (в стенке внутренней мембраны). Поступивший в цикл Кребса ацетил-КоА является конечным продуктом катаболизма не только углеводов, но также липидов и таких аминокислот, как фенилаланин, тирозин, лейцин и изолейцин.
Кроме того, существует прямой путь окисления глюкозы – гексозомонофосфатный (пентозный) цикл, который преобладает в эритроцитах половых железах, коре надпочечников, печени. Хотя окисление в гексозомонофосфатном цикле составляет всего 2% от обмена углеводов (при сахарном диабете может увеличиваться до 6%), для организма значение этого цикла очень велико. Особенность этого процесса – образование пентоз, накопление NADPH (2)-кофермента дегидрогеназ, участвующих в синтезе нуклеиновых кислот, холестерина, жирных кислот, активировании фолиевой кислоты и образовании АТФ. Гексозомонофосфатный цикл обеспечивает также процессы гидроксилирования, необходимые для синтеза биогенных аминов (катехоламины, серотонин) и стероидных гормонов коры надпочечников. Последовательная цепь реакций пентозного цикла (схема 7) приводит к образованию рибулозо-5-фосфата, который идет на построение нуклеотидов или серией обратных реакций преобразуется в гексозофосфаты с использованием их в гликолитическом цикле.
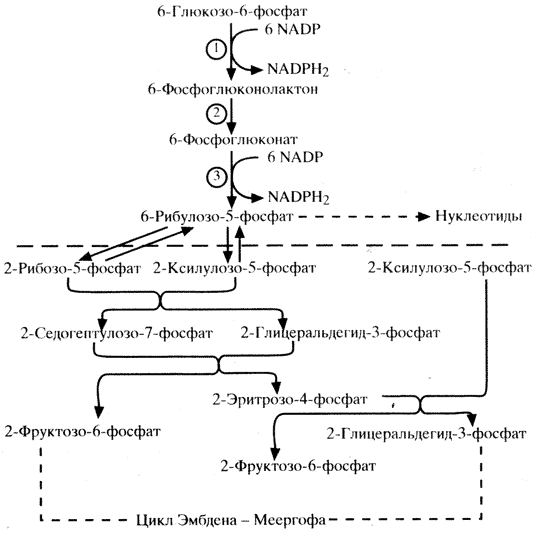
1 – глюкозо-6-фосфатдегидрогеназа; 2 – глюконолактоназа; 3 – фосфоглюконатдегидрогеназа.
По мере расходования запасов гликогена глюкоза может ресинтезироваться из молочной кислоты (лактата), аминокислот и других соединений. Этот процесс носит название глюконеогенеза. Образование глюкозы из лактата осуществляется в печени (цикл Кори). При этом из лактата образуется пируват, далее Г-6-Ф, который превращается затем в гликоген или глюкозу в зависимости от состояния обмена веществ в организме (схема 8). Превращение лактата в глюкозу может происходить и в волокнах белых мышц, но при этом необходима высокая концентрация лактата и высокое соотношение концентраций АТФ и АДФ. Глюконеогенез в незначительной степени происходит и в почках при более низкой концентрации лактата. Образование глюкозы из лактата – энергоемкий процесс, требующий достаточного количества АТФ. В печени соотношение АТФ и АДФ составляет около 10, в других тканях оно ниже. В цикле Кори из лактата образуется пируват, далее – Г-6-Ф, который превращается в глюкозу, поступающую в кровоток и в мышцах преобразующуюся в гликоген.
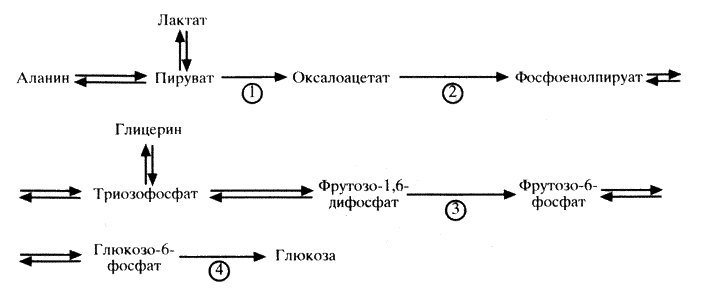
1 – пируваткарбоксилаза; 2 – фосфоенолпируваткарбоксилаза; 3 – фруктозо-1,6-дифосфатаза; 4 – глюкозо- 6-фосфатаза.
Важную роль в процессах глюконеогенеза играет так называемый цикл аланина, который происходит в мышечной ткани. При голодании вследствие катаболизма белков высвобождаются аминокислоты, более 50% количества которых составляет аланин. Поступая в печень, он используется там не для синтеза белка, а для образования Г-6-Ф через стадию пирувата. Некоторое количество аланина также через стадию пирувата превращается в Г-6-Ф непосредственно в мышечной ткани. В мышцах аланин образуется из пировиноградной кислоты. Основными донаторами группы NH(2) при этом являются такие аминокислоты, как лейцин, изолейцин, валин.
Таким образом, количество глюкозы в крови, оттекающей от печени, зависит в основном от двух взаимосвязанных процессов: гликолиза и глюконеогенеза, которые в свою очередь регулируются ключевыми ферментами фосфофруктокиназой и фруктозо-1, 6-бисфосфатазой соответственно. Активность этих ферментов адаптирована к пищевому и гормональному состоянию организма. Как отмечалось выше, фосфофруктокиназа является ключевым ферментом гликолиза и ее активность контролируется рядом метаболитов. За последние 10 лет многочисленными исследованиями показано, что основным таким регулятором является фруктозо-2, 6-бисфосфат – активатор фосфофруктокиназы. Прием глюкозы увеличивает количество в печени фруктозо-2, 6-бисфосфата, а глюкагон снижает его количество. Фруктозо-2, 6-бисфосфат синтезируется из фруктозо-6-фосфата и АТФ под воздействием 6-фосфофрукто-2-киназы. Этот же белок обладает также фруктозо-2, 6-бисфосфатазной активностью, которая расщепляет фруктозо-2, 6-бисфосфат на фруктозо-6-фосфат и неорганический фосфор. Таким образом, этот фермент является как бы многофункциональным и его фосфорилирование цАМФ-зависимой протеинкиназой снижает киназную и увеличивает фосфатазную активности, что приводит к уменьшению фруктозо-2, 6-бисфосфата.
Аффинность печеночной фосфофруктокиназы к фруктозо-2, 6-фосфату в 100 раз выше, чем к фруктозо-1, 6-бисфосфату и более чем в 1000 раз выше, чем к глюкозо-1, 6-бисфосфату. Помимо активирования фосфофруктокиназы фруктозо-2, 6-бисфосфат угнетает фруктозо-1, 6-бисфосфатазу, а уменьшение его количества снижает конверсию фруктозо-6-фосфата в фруктозо-1, 6-бисфосфат и повышает конверсию фруктозо-1, 6-фосфата в фруктозо-6-фосфат, что усиливает процесс глюконеогенеза.
Таким образом, метаболизм глюкозы и контроль синтеза и распада гликогена отражает баланс между инсулином и глюкагоном на определенный отрезок времени. Глюкагон, активируя цАМФ-зависимую протеинкиназу, способствует фосфорилированию фосфорилазы киназы, фосфорилазы и гликогенсинтазы, которые увеличивают процессы глюконеогенеза. Одновременное угнетение гликолиза, наблюдаемое при этом, является следствием активирования пируваткиназы, фруктозо-1, 6-бисфосфатазы и 6-фосфофрукто-2-киназы/фруктозо-2, 6-бисфосфатазы, что уменьшает количество фруктозо-2, 6-бисфосфата с ингибированием гликолиза и активированием глюконеогенеза. Инсулин же, наоборот, способствует дефосфорилированию этих ферментов, что активирует синтез гликогена и гликолиз.
Источниками ресинтеза глюкозы также служат глицерин, образующийся при обмене липидов, и некоторые промежуточные продукты цикла Кребса – лимонная, кетоглутаровая, но в большей степени щавелевоуксусная кислоты.
Обмен глюкозы частично осуществляется и через образование глюкуроната (глюкуронатный цикл), который посредством промежуточных стадий ксилулозо-5-фосфата взаимосвязан с гексозомонофосфатным циклом. Глюкуронатный цикл у всех млекопитающих, кроме человека и морской свинки, является местом эндогенного образования аскорбиновой кислоты (витамин С). Глюкуронаты образуются в толстой кишке в процессе бактериального расщепления полисахаридов, поступают в печень, где и включаются в глюкуронатный цикл.
Необходимо отметить, что частично обмен глюкозы в организме осуществляется через образование полиолов (полиоловый путь). Последние относятся к спиртам и образуются посредством отщепления карбоксильной группы альдоз и кетоз при участии альдозоредуктазы либо полиолдегидрогеназы. Этим путем глицеральдегид превращается в глицерин, глюкоза – в сорбитол, галактоза – в галактитол (дульцитол), ксилоза – в ксилит, арабиноза – в арабитол. В качестве кофермента при образовании полиолов используется NADPH. Этот обмен глюкозы происходит, в частности, в периферических нервах, где концентрация сорбитола выше, чем в других органах. Затем сорбитол при участии фермента сорбитолгидрогеназы может окисляться с образованием фруктозы. В хрусталике глаза глюкоза может непосредственно преобразоваться во фруктозу. Оба соединения (сорбитол и фруктоза) способствуют накоплению воды в тканях вследствие гиперосмолярности, что имеет патогенетическое значение в развитии поздних осложнений сахарного диабета.
Наряду с глюкозой большое значение в обеспечении организма энергией имеют жиры. При голодании энергетические расходы в основном покрываются за счет жиров, тогда как глюкоза сохраняется для снабжения энергией мозга. Жирные кислоты угнетают поглощение глюкозы мышцами. При гипогликемии происходит мобилизация жирных кислот и увеличение окисления их в мышцах при одновременном снижении утилизации глюкозы, а прием углеводов и повышение уровня глюкозы в крови приводят к снижению липолиза и усилению липогенеза. Цикл глюкоза – свободные жирные кислоты (цикл Рэндла) является одним из механизмов, обеспечивающих гомеостаз глюкозы. Концентрация кетоновых тел также имеет прямое отношение к регуляции содержания глюкозы в крови.
Ацетил-КоА, являясь конечным продуктом гликолитического цикла, может использоваться как источник энергии (в цикле Кребса), а также участвовать в синтезе триглицеридов, холестерина, стероидов и образовании кетоновых тел (схема 9).
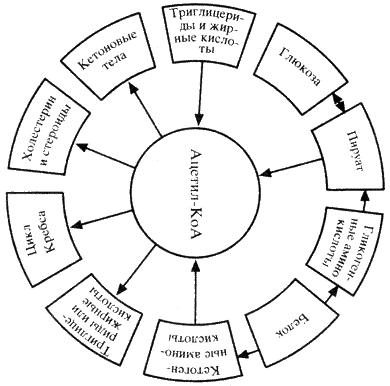
Основное место в гормональной регуляции гомеостаза глюкозы в организме отводится инсулину, под влиянием которого активируются ферменты фосфорилирования глюкозы (глюкокиназа в печени и гексокиназы в мышечной, жировой и других тканях), катализирующие образование Г-6-Ф. При увеличении его количества повышается активность процессов, для которых он является исходным продуктом (гексозомонофосфатный цикл и анаэробный гликолиз). Инсулин увеличивает долю участия глюкозы в процессах образования энергии при неизменном общем уровне энергопродукции. Активация Г-6-Ф, инсулином гликогенсинтетазы и гликогенветвящего фермента способствует увеличению синтеза гликогена. Наряду с этим инсулин оказывает ингибирующее влияние на глюкозо-6-фосфатазу печени и тормозит таким образом выход свободной глюкозы в кровь. Конечным результатом действия инсулина (при его избытке) является гипогликемия, стимулирующая секрецию гормонов-антагонистов инсулина, к которым относятся адреналин, норадреналин, глюкагон, CТГ, глюкокортикоидные и тироидные гормоны.
При относительной или абсолютной инсулиновой недостаточности нарушаются процессы поступления глюкозы в инсулинзависимые ткани, снижается окислительное фосфорилирование и образование Г-6-Ф, в последующем нарушаются гликолитическое окисление глюкозы, цикл Кребса и гексозомонофосфатный (пентозный) цикл, угнетается синтез гликогена и усиливается гликогенолиз.
Катехоламины стимулируют гликогенолиз в печени и мышцах. Увеличение синтеза цАМФ под влиянием катехоламинов и в большей степени адреналина активирует фосфорилазу печени, распад гликогена и образование большого количества свободной глюкозы. При этом увеличиваются поглощение кислорода, затраты энергии в связи с усилением сердечной деятельности, повышением мышечного тонуса и окислением молочной кислоты в печени.
Глюкагон, подобно адреналину, активирует аденилатциклазу, образование цАМФ, фосфорилазу, гликогенолиз и выход глюкозы из печени в кровяное русло. Это влияние намного сильнее, чем у адреналина. Однако глюкагон не действует на мышечную фосфорилазу, а следовательно, не мобилизует гликоген мышц. Гипергликемический эффект глюкагона является результатом стимуляции печеночного гликогенолиза и глюконеогенеза, индукции секреции адреналина, торможения проникновения глюкозы в мышцы.
Гормон роста увеличивает выход глюкозы в печеночные вены, усиливает глюконеогенез, уменьшает поглощение глюкозы на периферии, а также усиливает липолиз, в результате чего в крови повышается концентрация свободных жирных кислот, которые подавляют действие инсулина на мембранный транспорт глюкозы.
Глюкокортикоиды стимулируют катаболизм белков и глюконеогенез, повышают содержание гликогена в печени и в меньшей степени в мышцах, уменьшают мембранный транспорт глюкозы и ее утилизацию на периферии. Гипергликемическое действие АКТГ опосредуется в основном через глюкокортикоиды.
Жировой обмен. Жиры являются одним из основных источников энергии: 40-50% энергопродукции организма обеспечивается триглицеридами (триацилглицерины), на долю которых приходится более 95% всех липидов. В организме нормального человека с массой 70 кг на долю жировой ткани приходится 12 кг (110 000 ккал). Наряду с этим в крови определяется дополнительно 3 г триглицеридов (30 ккал), 0,3 г свободных жирных кислот (3 ккал) и 0,2 г кетоновых тел (0,8ккал). Период полураспада жирных кислот составляет несколько минут. Жиры, поступившие в кишечник с пишей, под влиянием гидролитических ферментов и желчи эмульгируются до мельчайших капель, специфические липазы, действующие на их поверхности, гидролизуют триглицериды, эфиры холестерина и фосфоглицериды до жирных кислот, диацилглицеринов, 2-моноацилглицеринов, глицерина, холестерина, лизофосфатидилхолина. Таким образом, в желудочно-кишечном тракте абсорбируется 40% холестерина и более 85% триглицеридов, поступающих с пищей. Перечисленные вещества, связываясь с желчными кислотами, образуют смешанные мицеллы, размеры которых на несколько порядков меньше, чем размеры частиц эмульсии. Такие мицеллы всасываются клетками эпителия тонкой кишки, в которых составные части мицеллы вступают друг с другом в реакции синтеза, в результате чего образуются простые и сложные липиды. Липиды и липопротеиды, синтезированные в эпителиальных клетках кишечника, образуют липидные капли, называемые хиломикронами. Они проникают в лимфатические сосуды и придают лимфе характерный вид молока. Лимфа, содержащая большое количество хиломикронов, через грудной проток попадает в венозную кровь. Водорастворимые жирные кислоты с короткой углеродной цепью и некоторая часть глицерина всасываются капиллярами портальной системы.
В плазме липиды представлены в виде триглицеридов, эстерифицированного и свободного холестерина, фосфолипидов. Липиды плазмы с помощью различных методов (электрофорез) разделяют на 5 классов: 1) хиломикроны; 2) липопротеиды очень низкой плотности (ЛОНП); 3) липопротеиды средней плотности (ЛСП); 4) липопротеиды низкой плотности (ЛНП); 5) липопротеиды высокой плотности (ЛВП, подразделяющиеся на два подкласса – ЛВП2 и ЛВП3). Химический состав липопротеидов плазмы представлен в табл. 1.
Таблица 1
|
Липопротеиды |
Белок |
Триглицериды |
Эфиры холестерина |
Свободный холестерин |
Фосфолипиды |
|
Хиломикроны |
2 |
85 |
4 |
2 |
8 |
|
ЛОНП |
10 |
60 |
13 |
8 |
18 |
|
ЛСП |
18 |
30 |
22 |
8 |
22 |
|
ЛНП |
25 |
7 |
40 |
10 |
20 |
|
ЛВП: |
|||||
|
ЛВП2 |
40 |
5 |
15 |
5 |
35 |
|
ЛВП3 |
55 |
3 |
12 |
4 |
25 |
Белки, входящие в состав липопротеидов, называются аполипопротеидами (табл. 2).
Таблица 2
|
Аполипротеид |
Молекулярная масса, Д |
Функция |
Место синтеза |
|
A-I |
28300 |
Связывает липиды, кофактор ЛХАТ*; входит в состав ЛВП (основной белок) |
Печень, кишечник |
|
A-II |
17400 |
Входит в состав ЛВП (второй белок), Активирует ЛХАТ (кофактор) |
Печень |
|
A-IV |
43000- 48000 |
Кофактор ЛХАТ |
Печень, кишечник |
|
B-100 |
513000 |
Транспорт триглицеридов в печени, маркер ЛОНП |
Печень |
|
В-48 |
246000 |
Транспорт триглицеридов в кишечнике, маркер хиломикронов |
Кишечник |
|
С-I |
6605 |
Активирование ЛХАТ |
Печень, Кишечник |
|
С-II |
8824 |
Активирование ЛПЛ (липо- |
Печень, |
|
протеиновая липаза) |
кишечник |
||
|
С-III |
8750 |
Ингибитор ЛПЛ (?), гликопротеин |
Печень, кишечник |
|
Д |
19000 |
Транспорт эфиров холестерина |
Печень |
|
Е |
34200 |
Распознавание липопротеидов связывание хилокронов в печени |
Печень |
Липиды плазмы транспортируются в виде специальных агрегатов – липопротеидов. В таких агрегатах различают сердцевину и оболочку. Сердцевина в свою очередь состоит из триглицеридов, эфиров холестерина В и эфиров жирных кислот, оболочка – из фосфолипидов, свободного холестерина и аполипопротеидов, обеспечивающих распознавание соответствующих рецепторов на поверхности клеток и активацию указанных выше ферментов.
Образование хиломикронов в кишечнике происходит при обязательном участии аполипопротеида В-48 (апо-В-48), который синтезируется в эпителиальных клетках кишечника. В состав хиломикронов, помимо апо-В-48, входит небольшое количество аполипопротеинов группы А. После попадания лимфы в грудной проток хиломикроны взаимодействуют с ЛВП, носителями аполипопротеидов группы С и Е; при участии липопротеидной липазы (ЛПЛ) триглицериды, содержащиеся в хиломикронах, гидролизуются на глицерин и свободные жирные кислоты (СЖК). ЛПЛ присутствуют на эндотелиальных поверхностях клеток мышцы сердца, жировой ткани и мышц скелета. СЖК способны проникать в клетки, где используются как источник энергии или участвуют в процессах липогенеза.
ЛОНП синтезируются в печени. Их сердцевина состоит из триглицеридов и эфиров холестерина. Белки, входящие в состав оболочки, представлены апо-В-100, апо-Е и апо-С. ЛОНП служат источником образования ЛСП и ЛНП.
ЛНП являются переносчиками эфиров холестерина, необходимого для синтеза стероидных гормонов, образования желчных кислот. Этот класс липопротеидов ответствен за транспорт 70% холестерина плазмы. В состав оболочки ЛНП входит апо-В-100, способный распознать соответствующий рецептор к ЛНП, синтез которого контролируется геном, расположенным на 19-й хромосоме. После взаимодействия ЛНП с рецептором образующийся комплекс проникает внутрь клетки, где в области лизосом под влиянием лизосомальных ферментов происходит гидролиз сердцевины и высвобождение свободного холестерина.
ЛВП образуются в печени и содержат фосфолипиды, свободный холестерин, апо-Е, апо-С и небольшое количество апо-А-1. ЛВП связывают свободный холестерин на периферии и транспортируют его к печени. ЛВП содержат ЛХАТ (лецитин/холестерин ацилтрансфераза), которая активирует перенос ацетиловой группы фосфолипидов на свободный холестерин, осуществляя эстерификацию холестерина. Эфиры холестерина депонируются во многих тканях организма (кора надпочечников и др.) и по мере необходимости используются для биосинтеза соответствующих веществ.
Выше указывалось, что в результате обмена углеводов образуются ацетил-КоА, АТФ, NADPH (2), глицерол-3-фосфат, используемые для синтеза жира, и количество липидов, накапливающихся в жировых депо, в большей степени зависит от содержания в пищевом рационе углеводов, а не жиров.
Липогенез – процесс синтеза жирных кислот, интенсивно протекающий в печени и жировой ткани. Следует отметить, что биосинтез липидов осуществляется в основном в цитоплазме клетки и лишь незначительная их часть, как считают некоторые авторы, образуется в митохондриях.
Образовавшийся в митохондриях ацетил-КоА способен проникать через их мембрану в цитоплазму только после взаимодействия с оксалоацетатом и образования цитрата, который достигает цитоплазмы, где вновь превращается в ацетил-КоА и оксалоацетат. Таким образом, оксалоацетат выполняет функцию катализатора, способствуя переносу ацетильной группы из интрамитохондриального пространства в цитозоль, где при участии ацетил-КоА-карбоксилазы происходит карбоксилирование ацетил-КоА с образованием малонил-КоА. Последний, взаимодействуя с комплексом жирные кислоты – белок при участии АТФ и КоА, превращается в комплекс жирнокислотный ацетил-КоА, что является необходимой стадией образования триглицеридов.
Карбоксилирование ацетил-КоА является важным регулятором синтеза жирных кислот и на всех последующих этапах липогенеза участвуют либо малонил-КоА, либо ацетил-КоА. Так под влиянием синтетазы жирных кислот и при использовании одной молекулы ацетил-КоА и 7 молекул малонил-КоА образуется пальмитил-КоА, способный к разнообразным превращениям. При потере одной молекулы СО2 и КоА образуется пальмитиновая кислота, молекула которой содержит 16 атомов углерода. Путем удлинения цепи в митохондриях или в плазматическом ретикулуме до 18 атомов углерода пальмитиновая кислота может быть превращена в стеариновую, а после десатурации она же преобразуется в пальмитоолеиновую и олеиновую кислоты.
При эстерификации жирных кислот с глицерином образуются триглицериды, причем в реакции участвует не свободный глицерин, а его производное – глицерол-3-фосфат, образующийся в печени из глицерина при участии глицеролкиназы. Эстерификация жирных кислот в жировой ткани может происходить лишь при достаточном поступлении дигидроксиацетонфосфата, который образуется в процессе гликолиза и конвертируется в глицерол-3-фосфат при участии глицерофосфатдегидрогеназы.
В печени и жировой ткани инсулин увеличивает синтез жирных кислот и триглицеридов. При эндогенном биосинтезе триглицеридов, кроме глюкозы, могут использоваться соединения, образующиеся из гликогенных аминокислот. Липогенез в печени контролируется тиротропным гормоном и гормонами щитовидной железы. Так, после гипофизэктомии синтез липидов печенью уменьшается и восстанавливается после введения тироксина.
Липолиз – процесс гидролиза липидов с образованием неэстерифицированных жирных кислот и глицерина – катализируется внутриклеточной гормональнозависимой липазой (триацилглицериновая липаза), которая воздействует на триглицериды и стимулируется цАМФ. Липаза лимитирует скорость липолиза, а образование цАМФ под влиянием аденилатциклазы находится в свою очередь под контролем различных гормонов.
Мембрана адипоцитов содержит рецепторы, взаимодействующие с гормонами, обладающими липолитическими свойствами (катехоламины, АКТГ, СТГ), и рецепторы к инсулину. В результате действия липолитических гормонов повышается активность аденилатциклазы, увеличивается образование цАМФ, активизируются ЛПЛ и липолиз жира. Взаимодействие инсулина с соответствующими рецепторами, наоборот, приводит к угнетению аденилатциклазы, снижению концентрации цАМФ и торможению липолиза. Липолиз увеличивается во время голодания, при продолжительной работе, охлаждении, стрессе. Липолитическое действие катехоламинов (адреналина, норадреналина) и глюкагона осуществляется путем активации аденилатциклазы. С физиологической точки зрения, роль норадреналина в процессе липолиза представляется более важной, чем адреналина. Он образуется в адренергических нервных окончаниях в жировой ткани и обеспечивает мобилизацию жирных кислот.
Гормон роста оказывает мощное липолитическое действие, которое отличается от действия катехоламинов. Он вызывает увеличение концентрации свободных жирных кислот в плазме через 2-3 часа. Это действие, отмечающееся при введении даже небольших доз СТГ, по-видимому, связано с торможением процесса реэстерификации свободных жирных кислот. Тем не менее СТГ оказывает определенное модулирующее влияние и на активность аденилатциклазы.
Другие гипофизарные гормоны (АКТГ, ТТГ, меланоцитостимулирующий гормон) также оказывают липолитическое действие, хотя и менее выраженное, чем у СТГ. Большинство авторов считают, что оно осуществляется путем активации аденилатциклазы и повышения скорости образования цАМФ.
Тироидные гормоны и кортикостероиды оказывают пермиссивное (разрешающее) действие на липолиз, поскольку липолитический и калоригенный эффекты катехоламинов не проявляются в отсутствие кортикостероидов и тироидных гормонов. Имеются данные о том, что ТТГ, АКТГ, гормоны щитовидной железы и коры надпочечников индуцируют синтез аденилатциклазы и, следовательно, принимают непосредственное участие в стимуляции липолиза. Кроме того, тироидные гормоны влияют на активность ацил-КоА-синтетазы, локализующейся в митохондриях, и цитоплазматического фермента глицеролфосфатдегидрогеназы. Эти ферменты участвуют в регуляции скорости липолиза и липогенеза.
Как уже отмечалось, инсулин обладает характерным антилиполитическим свойством, и при сахарном диабете вследствие увеличения липолиза повышается концентрация свободных жирных кислот в плазме, снижению которой способствует инсулинотерапия.
Белковый обмен. Белки в организме также являются источником энергии. Они содержатся главным образом в мышцах и их количество составляет в организме здорового человека массой 70 кг около 6000 г, что соответствует 24 000 ккал. Циркуляция их в крови в виде аминокислот незначительна и составляет всего 6 г, или 24 ккал. Белки – необходимый компонент любой ткани организма – поступают в организм с пищей и в желудочно-кишечном тракте после воздействия на них ферментов (пепсина, трипсина) гидролизуются до небольших пептидов и аминокислот, которые затем всасываются в кровь и лимфу. В организме человека для синтеза пуринов, пиримидинов, порфиринов используются только аминокислоты, поэтому все поступающие с пищей белки должны быть диссоциированы в различных ферментативных реакциях до отдельных аминокислот.
Некоторые аминокислоты могут синтезироваться в организме, поэтому называются заменимыми: аланин, аспарагиновая кислота, цистеин, глутаминовая кислота, глицин, пролин, серин, тирозин, аспарагин, глутамин; другие же не могут быть синтезированы и называются незаменимыми: лейцин, изолейцин, валин, лизин, метионин, фенилаланин, триптофан, треонин, гистидин, аргинин (гистидин и аргинин синтезируются в организме взрослого человека).
Синтез белка – сложный процесс, происходящий постоянно. Информация о структуре любого белка данного организма хранится в хромосомах в виде генетического кода. При поступлении сигнала о необходимости синтеза определенного белка с участка ДНК, на котором закодирована структура данного белка, при участии фермента РНК-полимеразы начинает образовываться мРНК. Процесс образования мРНК называется “транскрипция”. Если молекула ДНК относительно стабильна, то период полураспада мРНК составляет 2-80 ч (время, необходимое для синтеза белка).
Образовавшаяся мРНК покидает ядро и направляется к рибосомам, где и осуществляется синтез белка. На рибосомах локализуются рибосомальная РНК (рРНК) и транспортная РНК (тРНК), которые вместе участвуют в процессе считывания информации, заложенной в мРНК, и“сборки” нового белка. Обычно рРНК и метионил-тРНК присоединяются к специальной точке мРНК, и с этого момента начинается их движение вдоль молекулы мРНК, во время которого “считываются” триплетные кодоны и начинается “сборка” полипептидной цепи нового белка.
Аминокислоты могут использоваться рибосомами лишь после их активации соответствующими ферментами, число которых по всей вероятности соответствует количеству аминокислот.
Гормоны влияют на скорость синтеза белка несколькими путями: повышением или снижением активности ферментов, участвующих в процессе “сборки” белковой молекулы, изменением транспорта аминокислот, необходимых для синтеза белка, повышением активности и скорости образования рибосом, осуществляющих синтез белка, повышением скорости начала образования полисом, повышением активности РНК-полимеразы и скорости образования мРНК. Некоторые вещества могут в той или иной степени ингибировать перечисленные процессы. Так, актиномицин, связываясь с ДНК, угнетает синтез мРНК и таким образом препятствует действию гормонов на процессы транскрипции. Пуромицин угнетает синтез белка, влияя на тРНК, и ингибирует гормональную регуляцию процессов трансляции.
Наряду с процессами синтеза белка в организме постоянно протекают процессы белкового катаболизма, конечным продуктом которого у человека является мочевина. Аммиак, образующийся в большинстве клеток в процессе катаболизма аминокислот, наряду с другими азотсодержащими веществами превращается в печени в мочевину в цикле Кребса-Гензелейта (схема 10). При этом аммиак транспортируется в печень не в свободной форме, а детоксицируется глутаматом с образованием глутамина под влиянием фермента глутаминсинтетазы. В митохондриях печени глутамин при участии глутаминазы вновь диссоциирует на аммиак и глутамат. Последний возвращается в ткани, а аммиак используется для образования карбамоилфосфата с помощью фермента карбамоилфосфатсинтетазы.
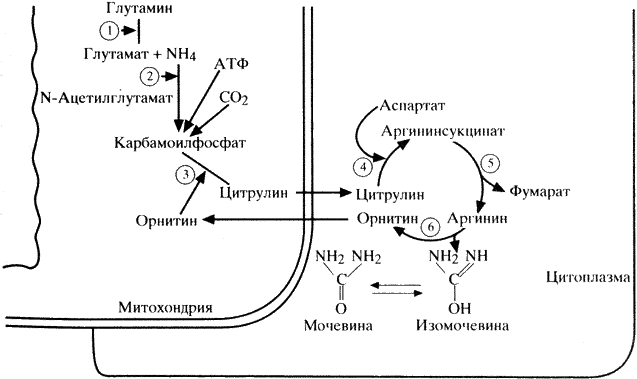
1 – глутаминаза; 2 – карбамоилфосфатсинтетаза; 3 – орнитинкарбамоилтрансфераза; 4 – аргининсукци- натсинтетаза; 5 – аргининсукцинатлиаза; 6 – аргиназа.
Другим основным для начального биосинтеза мочевины митохондриальным ферментом является орнитинкарбамоилтрансфераза, катализирующая образование цитрулина из карбамоилфосфата и орнитина. Цитрулин через митохондриальную мембрану проникает в цитоплазму клетки, где взаимодействует с аспартатом при участии аргиносукцинатсинтетазы, в результате чего образуется аргиносукцинат, который под воздействием аргиносукцинатлиазы диссоциирует на аргинин и фурамат. Аргинин с помощью аргиназы распадается на мочевину и орнитин, транспортируемый обратно в митохондрии, где он вступает в новый цикл образования цитрулина. Для образования одной молекулы мочевины в цикле Кребса-Гензелейта используется 4 молекулы АТФ (Бонди Ф., Розенберг Л., 1980).
В зависимости от путей катаболизма различают глюкогенные, кетогенные и смешанные аминокислоты. Кетогенной аминокислотой является лейцин, который распадается на ацетоуксусную кислоту и ацетил-КоА, вызывающие повышение уровня кетоновых тел в крови. Изолейцин, лизин, фенилаланин и тирозин – глюкогенные и кетогенные аминокислоты. Фенилаланин и тирозин распадаются на фурамат и ацетоацетат, которые могут быть использованы в процессах глюконеогенеза. К глюкогенным аминокислотам относятся аланин, аргинин, аспарагиновая кислота, цистеин, глутаминовая кислота, глицин, гистидин, гидроксипролин, метионин, серин, треонин, триптофан, валин. Продукты распада этих аминокислот участвуют в процессах глюконеогенеза.
Количество аминокислот в сыворотке крови поддерживается постоянно на определенном уровне за счет поступления их из желудочно-кишечного тракта и депо, которыми являются печень и мышцы. В мышцах содержится более 50% общего количества свободных аминокислот организма. Наиболее мобильны из них аланин и глутамин, составляющие более 50% всех аминокислот, высвобождающихся из мышц. Аланин синтезируется в мышцах путем трансаминирования пирувата. Глутамин поступает в почки, где отщепляющийся азот используется для образования аммиака. Аланин же задерживается печенью, где быстро конвертируется в глюкозу через образование пирувата. Последний процесс получил название цикла аланина и наряду с циклом лактата (цикл Кори) имеет большое значение в процессах глюконеогенеза. Взаимоотношения этих двух циклов представлены на схеме 11.
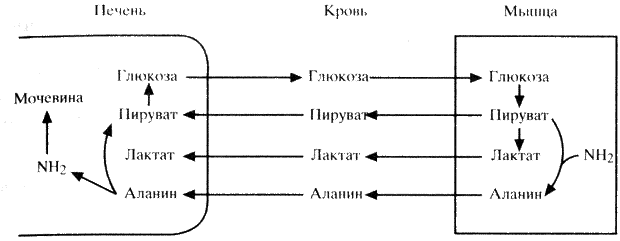
Эндокринная система участвует в регуляции белкового обмена как непосредственно, так и опосредованно – путем первичного влияния на углеводный, жировой и минеральный обмен.
По воздействию на белковый обмен все гормоны можно разделить на две большие группы: 1) гормоны, первичное действие которых – стимуляция процессов транскрипции – проявляется в ядре клетки (стероидные и тироидные гормоны); 2) гормоны, стимулирующие процессы трансляции, происходящие дистальнее ядра клетки.
Анаболическое действие инсулина заключается в ускорении проникновения аминокислот через мембрану клетки и включения их в белки, что вызывает снижение уровня аминокислот в крови. Это действие инсулина не зависит от синтеза РНК и не угнетается актиномицином. Инсулин снижает активность аминотрансфераз и ферментов цикла мочевины. Последний эффект инсулина характеризуется повышением активности РНК-полимеразы и концентрации РНК в печени. При этом увеличивается скорость образования полисом и рибосом.
Действие инсулина на синтез белка в печени противоположно действию глюкагона, который усиливает катаболизм аминокислот и мобилизует их для процессов глюконеогенеза.
Основным эффектом действия гормона роста является стимуляция анаболичесих процессов, чем и обусловливается ускорение роста скелета при гиперсекреции этого гормона. Он, так же как инсулин, стимулирует транспорт аминокислот и их включение рибосомами в белки, повышает скорость образования полисом и рибосом, активность РНК-полимеразы, увеличивает количество РНК в клетках, что сопровождается повышением скорости синтеза белков. Гормон роста угнетает активность ферментов, разрушающих аминокислоты, повышает уровень инсулиноподобных факторов роста I и II (ИФР I и II) в сыворотке крови, стимулирует синтез коллагена в костях, коже, других органах и тканях организма.
Введение в кровь тироидных гормонов сопровождается усилением основного обмена, тахикардией, уменьшением содержания гликогена в мышце сердца, увеличением чувствительности тканей к липолитическому действию адреналина. Влияние тироидных гормонов на обмен веществ обнаруживается лишь через 48 часов и более, т.е. значительно позже, чем действие инсулина и СТГ.
Усиление основного обмена после введения тироидных гормонов является следствием увеличения количества и размера митохондрий, количества рибосом, содержания в них цитохрома и образования митохондриальной мембраны. Тироидные гормоны не влияют на транспорт аминокислот. Под действием этих гормонов возрастает активность ферментов, в том числе глицеролфосфатдегидрогеназы, цитохромоксидазы, цитохрома С, NAD-изолимонной дегидрогеназы, а также РНК-полимеразы и увеличивается синтез РНК (включая мРНК).
Под влиянием эстрогенов увеличивается содержание РНК, особенно в тканях-мишенях, и количество белка, повышаются активность РНК-полимеразы и скорость синтеза РНК. Считается, что после связывания эстрогенов с негистоновыми белками хроматина ядра происходит стимуляция определенной области генома, образование новых видов РНК и некоторых специфических (кислых) белков. Длительность первой фазы действия эстрогенов от нескольких минут до 1-2 ч. После этого вновь образовавшиеся белки увеличивают содержание РНК, что приводит к усилению синтеза белка. Длительность второй фазы гормонального эффекта составляет 4 ч и более.
Андрогены оказывают на белковый обмен такое же действие, как и эстрогены. Кроме того, тестостерон и другие андрогены влияют на развитие мышечной ткани, улучшая транспорт аминокислот и повышая активность РНК-полимеразы.
При введении больших доз глюкокортикоидов наблюдается быстрое уменьшение мышечной массы и снижение скорости включения аминокислот в белки мышц, селезенки, костной ткани, отмечается снижение активности РНК-полимеразы и способности изолированных рибосом поглощать (включать) аминокислоты. Эти изменения не распространяются на печень, где увеличивается синтез ферментов, участвующих в процессах глюконеогенеза и разрушения аминокислот, в том числе глюкозо-6-фосфатазы, фосфоенолпируваткарбоксикиназы, пируваткарбоксилазы и др.
Таким образом, гормоны регулируют все виды обмена веществ (углеводный, жировой, белковый, минеральный и др.), поддерживая постоянство внутренней среды, которое, как установил еще Клод Бернар, является непременным условием жизнедеятельности организма.
Дом престарелых в Москве https://dom-invalidov.ru/doma-prestarelyh/, пансионат для больных.