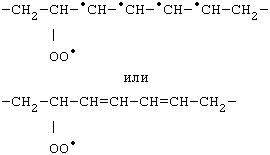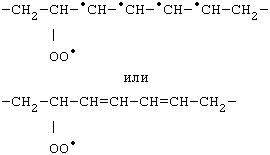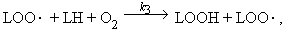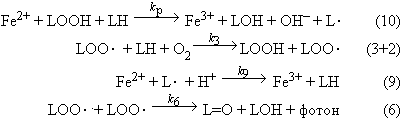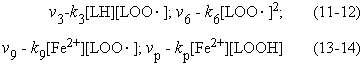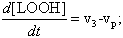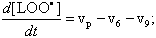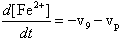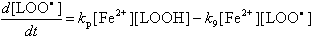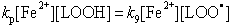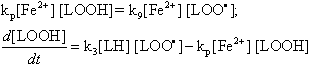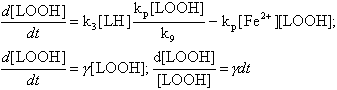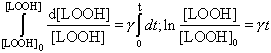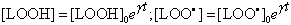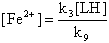ПОКАЗАТЬ ПЛАНПЕРЕЙТИ В КОНЕЦ
Лекция 8
Кинетика реакций цепного окисления липидов
Общая схема реакций
Примером сложной системы химических реакций может служить цепное окисление липидов.
Кинетика процесса перекисного окисления обладает большой сложностью, иллюстрацией чего могут служить экспериментальные кривые, приведенные на рис.1. К суспензии митохондрий, выделенных из печени крысы, добавляли FeSO4 и наблюдали за изменением концентрации ионов Fe2+, продукта перекисного окисления липидов - малонового диальдегида, а также за интенсивностью хемилюминесценции, сопровождающей процесс перекисного окисления липидов. Можно видеть сложность кинетических кривых, что отражает сложность самой реакции цепного окисления липидов.
Эта реакция включает в себя несколько стадий.
Инициирование цепи
При взаимодействии сильного окислителя с ненасыщенной жирной кислотой, точнее с -CH2- группой в a-положении по отношению к двойной связи происходит отрыв атома водорода от этой связи и образуется свободный радикал (алкил-радикал) жирной кислоты (L·). В качестве реагента, способного отрывать атом водорода чаще всего служит свободный радикал, например, радикал гидроксила HO·:
HO· + –CH2–CH=CH–CH2–CH=CH–CH2–
H2O + –CH2–CH=CH–•CH–CH=CH–CH2– |
Реакция инициирования может быть записана в виде простого химического уравнения:
Двойная связь, как известно, образуется одной парой s-электронов и двумя p-электронами. В молекуле полиненасыщенных жирных кислот имеется не одна, а две или более двойных связей, но они разделены группой -CH2- (метиленовым мостиком). Двойные связи и p-электроны локализованы. В радикале L· имеется не один, а пять одинаковых p-электронов, расположенных у соседних углеродных атомов, как это изображено ниже:
| –CH2–•CH–•CH–•CH–•CH–•CH–CH2– |
Нельзя определить, какие же из этих электронов образуют двойные связи. Все они находятся в равном положении, и присоединение какой-либо химической группы к любому из этих пяти углеродных атомов примерно равновероятно. Можно сказать, что свободная валентность принадлежит не конкретному атому углерода, а делокализована.
Продолжение цепи
В кислородсодержащей среде происходит быстрое присоединение молекулы кислорода к одному из атомов углерода с неспаренным электроном, обычно к крайнему. Образуется радикал перекиси липида:
В дальнейшем мы будем обозначать такой радикал знаком LO2· и называть его липидным диоксиалкил-радикалом. Реакция образования диоксил-радикала может быть теперь описана таким химическим уравнением:
Радикал LO2· легко отнимает атом водорода от одной из соседних ненасыщенных жирных кислот (LH):
| LO2· + LH -> LOOH + L· |
(3) |
Образуется новый липидный алкил-радикал, а затем реакции 2 и 3 повторяются.
Перекисное окисление липидов - это цепная реакция, и её можно наглядно изобразить следующим образом: см. рис.2.
В реакцию продолжения цепи вовлекаются всё новые и новые молекулы субстратов, т.е. молекулярный кислород O2 и полиненасыщенные жирные кислоты LH, и в каждом звене этой цепной реакции образуется молекула продукта - гидроперекиси липида LOOH. В каждый данный момент протекает какая-то одна частная реакция цепного окисления, так что цепи разворачиваются во времени, а не в пространстве.
Обрыв цепей
В конце концов цепи обрываются, поскольку свободные радикалы L·и LO2·, "ведущие" цепи окисления, исчезают из-за одной из возможных реакций обрыва цепей. Это могут быть следующие реакции:
| L· + L· -> LL |
(4) |
| L· + LO2· -> LOOL |
(5) |
| LO2· + LO2· -> L=O + LOH + фотон |
(6) |
Последняя реакция диспропорционирования радикалов LO2· интересна тем, что она сопровождается свечением - хемилюминесценцией.
В липид-содержащих системах длина цепей может составлять десятки и сотни звеньев. Для организма цепное окисление липидов - весьма нежелательное явление не только потому, что оно приводит к бесполезному сжиганию ценных компонентов клетки, но ещё и потому, что некоторые продукты цепного окисления липидов чрезвычайно токсичны. В связи с этим имеется целая система защиты от перекисного окисления, в частности, имеются вещества, "перехватчики" свободных радикалов, которые тормозят цепное окисление за счёт ещё одной реакции обрыва цепей:
где In· - свободный радикал ингибитора цепного окисления. К числу молекул - перехватчиков радикалов относятся токоферол (витамин Е), женские половые (стероидные) гормоны, коэнзим Q (убихинон), многие другие соединения. Хотя в реакции 7 образуются радикалы этих соединений, эти радикалы недостаточно активны, чтобы оторвать атом водорода от молекул жирных кислот, и поэтому не инициируют новых цепей окисления. Обычно они быстро исчезают, например, вследствие взаимодействия друг с другом:
Все соединения, тормозящие процессы цепного окисления липидов, называются антиоксидантами. К числу антиоксидантов относятся и перехватчики свободных радикалов.
Антиоксидантными свойствами в определённых условиях обладают ионы металлов переменной валентности в восстановленной форме, в частности, ионы Fe2+. Они также способны перехватывать свободные радикалы в одной из следующих реакций:
| Fe2+ + L· + H+ -> Fe3+ + LH |
(9) |
| Fe2+ + LO2· + H+ -> Fe3+ + LOOH |
(9a) |
Разветвление цепей
В большинстве случаев ионы Fe2+ обладают однако не анти-, а прооксидантным действием, т.е. они не подавляют, а наоборот, резко усиливают процессы перекисного окисления. Это происходит потому, что ионы двухвалентного железа вступают в реакцию с продуктом перекисного окисления - гидроперекисями липидов:
| Fe2+ + LOOH -> Fe3+ + LO· + OH- |
(10) |
В результате появляется новый свободный радикал (алкоксильный радикал липида) LO·, который инициирует образование новой цепи окисления:
| LO· + LH -> LOH + L· |
(11) |
| L· + O2 -> LO2· |
(2) |
| LO2· + LH -> LOOH + L· |
(3) |
и далее реакции 2-3, 2-3, 2-3 и т.д.
Разветвление цепей более наглядно видно на рис.3.
Математическое моделирование кинетики цепного окисления
Упрощение схемы реакций
Совокупность химических уравнений кинетики цепного окисления липидов выглядит солидно:
| HO· + LH -> HOH + L· |
(1) |
| L· + O2 -> LO2· |
(2) |
| LO2· + LH -> LOOH + L· |
(3) |
| L· + L· -> LL |
(4) |
| L· + LO2· -> LOOL |
(5) |
| LO2· + LO2· -> L=O + LOH + фотон |
(6) |
| L· + InH -> LH + In· |
(7) |
| In· + In· -> In-In |
(8) |
| Fe2+ + L· + H+ -> Fe3+ + LH |
(9) |
| Fe2+ + LO2· + H+ -> Fe3+ + LOOH |
(9a) |
| Fe2+ + LOOH -> Fe3+ + LO· + OH- |
(10) |
| LO· + LH -> LOH + L· |
(11) |
Система дифференциальных уравнений, описывающих процесс, будет очень сложной, а константы скоростей большинства перечисленных реакций неизвестны. Можно однако существенно упростить систему химических, а значит - и дифференциальных уравнений кинетики, если использовать два важных закона химической кинетики:
| Правило 1: Скорость нескольких последовательных реакций равна скорости самой медленной из них. |
Это правило позволяет заменить последовательные реакции одной обобщённой реакцией, приняв константу скорости этой реакции равной константе скорости самой медленной из последовательных реакций. В нашем случае реакции 2 и 3 - это последовательные реакции. Для наших целей не очень важно, какую из них считать более медленной. В кислородсодержащей среде скорость реакции 3 во много раз ниже скорости реакции 2, поэтому уравнение реакции продолжения цепи можно записать так:
а константа скорости этой реакции будет равна константе скорости реакции 3, которую мы обозначим как k3; константы скоростей мы в дальнейшем будем писать над стрелкой в химическом уравнении реакции.
| Правило 2: Из нескольких параллельных реакций наибольшую роль играет самая быстрая; для простоты, остальными реакциями иногда можно пренебречь. |
Это правило позволяет заметно упростить приведенную выше схему из одиннадцати реакций.
- В присутствии кислорода воздуха радикалов LO· и L· гораздо меньше, чем радикалов LOO·; поэтому реакциями 4 и 5 можно пренебречь оставив только одну реакцию взаимодействия радикалов - реакцию 6.
- При наличии в среде ионов Fe2+ и при незначительной концентрации других антиоксидантов часто можно пренебречь реакцией 7, оставив реакцию 9. Реакцию 9а мы тоже не будем пока принимать во внимание.
- В отсутствие иных источников свободных радикалов, образование новых радикалов происходит только в реакции 10 (реакция разветвления цепей). Обозначим константу скорости этой реакции как kp. Реакцией 1 можно пренебречь, если нет источника радикалов HO·.
После всех этих упрощений получаем систему химических уравнений цепного окисления липидов, содержащую всего четыре реакции:
Дифференциальные уравнения кинетики
Реакции 9 и 10 выглядят, как тримолекулярные, или как реакции третьего порядка. В водной забуференной среде, однако, концентрация протонов постоянна, и эту величину можно включить в постоянную - константу скорости k9. Поэтому мы будем рассматривать реакцию 9 как бимолекулярную с константой скорости второго порядка k9. Также и концентрация субстрата окисления LH внутри мембраны достаточно велика и мало изменяется во времени, поэтому и реакцию 10 можно рассматривать как бимолекулярную (второго порядка) с константой скорости kp.
После этого введения, запишем дифференциальные уравнения кинетики, описывающие скорости приведенных выше частных (или парциальных) реакций цепного окисления липидов:
Дифференциальные уравнения, описывающие изменение концентраций основных участников реакции с учётом уравнений, приведенных выше, можно записать так:
Расчеты концентраций компонентов на ЭВМ
Как ни старались мы упростить систему химических и дифференциальных уравнений кинетики, конечная система уравнений третьего порядка всё равно не может быть решена аналитически. Однако если мы знаем константы скоростей и начальные концентрации участников реакции, то можно рассчитать численным методом с использованием ЭВМ концентрации всех участников реакции как функцию времени.
Самый простой метод - Эйлера и Коши, при котором бесконечно малые заменяются на достаточно малые приращения, а интегрирование заменяется суммированием. Процедура вычислений сводится к следующему:
1) Переписываем систему дифференциальных уравнений в виде обычных алгебраических уравнений с использованием очень малых приращений концентраций веществ и времени:
 |
(18-20) |
2) Подставляем в правые части уравнений начальные значения [LOOH], [LOO·] и [Fe2+]. Задаём достаточно малую величину t и рассчитываем величины D1[LOOH], D1[LOO·] и D1[Fe2+].
3) Находим для времени t1 = 0 + t величины:
| [LOOH]1 = [LOOH]0 + D1[LOOH] |
(21) |
[LOO·]1 = [LOO.]0 + D1[LOO·] |
(22) |
[Fe2+]1 = [Fe2+]0 + D1[Fe2+] |
(23) |
4) Исходя из новых значений текущих концентраций [LOOH], [LOO·] и [Fe2+], рассчитываем новые значения приращений концентраций D2[LOOH], D2[LOO·] и D2[Fe2+].
5) Находим для времени t2 = t1 + Dt величины:
| [LOOH]2 = [LOOH]1 + D2[LOOH] |
(24) |
[LOO·]2 = [LOO·]1 + D2[LOO·] |
(25) |
[Fe2+]2 = [Fe2+]1 + D2[Fe2+] |
(26) |
Повторяя операции 4 и 5, рассчитываем концентрации участников реакции перекисного окисления липидов при каждом данном значении времени.
6) Строим рассчитанные кинетические кривые и сравниваем их с данными эксперимента.
В качестве такого рода экспериментальных данных могут служить кривые тапа приведенных на рис.1 (суспензия митохондрий) или на рис.4 (суспензия фосфолипидных везикул - липосом).
Аналитическое решение уравнений кинетики
Дальнейшие упрощения схемы реакций
При некоторых дополнительных упрощениях системы удаётся свести систему дифференциальных уравнений до уравнения первого порядка, которое можно решить аналитически. Эти упрощения, правда лишают нас возможности построить всю кривую кинетики процесса, но позволяют рассчитывать её небольшие участки, а главное - лучше понять некоторые особенности реакций.
Первое упрощение основано на допущении, что скорости частных реакций значительно превышают скорость цепного окисления в целом. Смысл этого допущения можно пояснить, анализируя уравнение, описывающее скорость изменения концентрации радикалов LOO·:
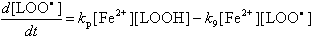 |
(27) |
Видно, что скорость появления новых радикалов определяется разностью скоростей двух частных реакций: разветвления цепи и обрыва цепи. Если считать, что скорость образования радикалов гораздо меньше скорости каждой из частных реакций, то можно приравнять нулю правую часть уравнения. Тогда
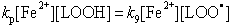 |
(28) |
Порядок системы уравнений понижается при этом на единицу. Такое упрощение, называемое стационарным приближением Боденштейна-Семёнова, предполагает большую длину цепей окисления. Надо однако заметить, что основной вывод, к которому мы подводим читателя, сохраняется и без допущения Боденштейна-Семёнова, но требует более сложных математических выкладок.
Запишем в развёрнутом виде уравнения - с учётом приближения Боденштейна-Семёнова:
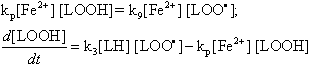 |
(29-30) |
В этих уравнениях кроме концентраций гидроперекисей и радикалов фигурирует ещё одна переменная - концентрация ионов железа. Чтобы решить систему уравнений, нам придётся использовать очень небольшие интервалы времени, в пределах которых величина [Fe2+] не успевает сильно измениться, и тогда мы можем рассматривать её как константу, величина которой в рассматриваемый момент времени нам известна.
С этим дополнительным допущением произведём подстановку значения [LOO·] из первого уравнения во второе и разделим переменные:
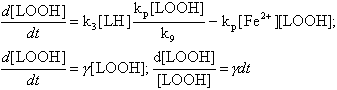 |
(31) |
где
 |
(32) |
Триггерная роль ионов двухвалентного железа
Проинтегрируем последнее уравнение *:
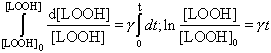 |
(33) |
Из этого уравнения, а также из уравнения ** следует, что
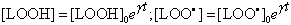 |
(34) |
Последние уравнения показывают, что как концентрация гидроперекисей в системе, так и концентрация цепей окисления (которая равна концентрации радикалов, ведущих цепи) изменяется во времени по экспоненте. Будет ли реакция самоускоряющейся или затухающей, зависит от знака индекса в показателе степени. При g>0 процесс будет самоускоряющимся, при g<0 - самозатухающим. Когда g=0, скорость процесса будет постоянной во времени.
От чего же зависит сам индекс?
Это можно увидеть, вернувшись к уравнению (32). g=0 при
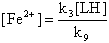 |
(35) |
Эту концентрацию железа мы назвали "критической концентрацией" обозначили как [Fe2+]*.
Из уравнений следует, что
g=0 при [Fe2+]=[Fe2+]* (стационарная реакция),
g>0 при [Fe2+]<[Fe2+]* (ускоряющаяся реакция),
g<0 при [Fe2+]>[Fe2+]* (затухающая реакция).
Вопросы для самоконтроля
- Кинетика реакций цепного окисления липидов. Основные стадии процесса.
- Кинетика реакций цепного окисления липидов. Полная схема химических реакций и пути её упрощения для анализа кинетики.
- Дифференциальные уравнения кинетики цепного окисления липидов. Принцип математического моделирования кинетики этих процессов.
- Аналитическое решение системы уравнений кинетики цепного окисления липидов. Триггерная роль ионов Fe2+.
ПОКАЗАТЬ ПЛАНПЕРЕЙТИ В НАЧАЛО