
Лекция 10
| Активатор + радикалы -> продукт* -> продукт + фотон |
| Радикалы -> продукт* -> продукт + фотон 1 |
| (неактивированная ХЛ) |
| Продукт* + активатор -> продукт + активатор* -> фотон 2 |
| (активированная ХЛ) |
| LOO· + LOO· -> LOH + L=O* + O2 |
| L=O* -> L=O + hn1 (слабое свечение; j = 10-4) |
| L=O* + А -> L=O + А* (перенос энергии) |
| А* -> А + hnA (яркое свечение; j = 10-2 - 10-1) |
| A + A* + анти-A -> A-анти-A + A*-анти-A |
| A + анти-A* -> A-анти-A* |
 |
 |
 |
| Люцифераза + Оксидоредуктаза + Альдегид + ФМН + НАД+ |
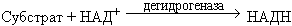 |