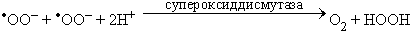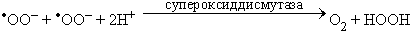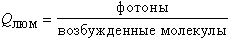ПОКАЗАТЬ ПЛАНПЕРЕЙТИ В КОНЕЦ
Лекция 9
Свечение, сопровождающее биохимические реакции
Хемилюминесценцией (ХЛ) называется свечение, сопровождающее химические реакции. Она наблюдается в том случае, если в реакции происходит выделение большого количества энергии, например в реакции взаимодействия двух радикалов или в реакциях с участием перекисей. Собственное ("сверхслабое") свечение клеток и тканей животных и человека обусловлено реакциями свободных радикалов: радикалов липидов и кислорода, а также окиси азота, – соединениями, играющими огромную роль в жизни организма, а при определенных условиях – и развитии ряда патологических состояний.
Введение
Энергично протекающие химические реакции сопровождаются, как правило, выделением энергии в форме тепла; существуют, однако такие реакции, которые сопровождаются излучением света. Свечение, сопровождающее химические реакции, называется хемилюминесценцией (ХЛ).
Процессы жизнедеятельности, как теперь стало известно, практически всегда сопровождаются очень слабым излучением, которое иногда называют сверхслабым свечением или собственным излучением клеток и тканей [1]. Некоторые организмы обладают, однако способностью излучать довольно яркий свет, видимый простым глазом; это явление известно с древних времен и получило название "биолюминесценция".
В биохимических системах, т.е. в гомогенатах тканей, суспензиях клеток или клеточных органелл, смесях ферментов и субстратов, собственная хемилюминесценция в большинстве случаев отличается крайне низкой интенсивностью, и требуется особо чувствительная аппаратура, чтобы его обнаружить и измерить. Некоторые вещества, которые в отечественной литературе принято называть активаторами ХЛ (в англоязычной литературе используется термин enhancer), обладают способностью усиливать хемилюминесценцию, иногда во много тысяч раз.
На рис.1 приведена классификация явлений хемилюминесценции в биологических системах.
Помимо этого, слабым свечением сопровождается образование свободных радикалов при действии ряда физических факторов на объект: при облучении ионизирующей радиации наблюдается радиохемилюминесценция, после облучения ультрафиолетом или видимым светом – фотохемилюминесценция, при пропускании электрического тока – электролюминесценция, при ультразвука – сонолюминесценция, при воздействии сил трения – триболюминесценция.
Молекулярный механизм хемилюминесценции
В настоящее время известно довольно много химических реакций, сопровождающихся свечением. В большинстве случаев – это довольно сложные процессы со многими промежуточными стадиями. Но есть несколько простых случаев, в которых механизм превращения энергии химической реакции в свет вполне понятен [1,2]. Один из них – это свечение, наблюдаемое при взаимодействии органических радикалов, получаемых электрохимическим путем (см. схему на рис.2).
В раствор люминесцирующего органического вещества (в опытах брали полициклические углеводороды) в органическом электролите (проводящем электричество) опускали пару электродов, с помощью которых через раствор пропускали электрический ток. С катода (-) на молекулы люминесцирующего вещества (обозначим их как НА) переходят электроны и образуются анион-радикалы (заряженные отрицательно). На аноде (+) электроны отнимаются от молекул и образуются катион-радикалы (заряженные положительно, см. рис.2, вверху). Если теперь раствор перемешать, катион-радикалы будут взаимодействовать с анион-радикалами (рис.2, внизу); при этом образуется две молекулы исходного углеводорода, одна из которых может оказаться в электронно-возбужденном состоянии и переходит в основное состояние с испусканием кванта света (фотона). На рис.3 показаны верхние электронные энергетические уровни в реагирующих радикалах и продуктах их взаимодействия. В молекулах на верхнем заполненном электронном уровне электроны расположены попарно (рис.3, 1).
У катион-радикала на верхнем уровне остается только один, неспаренный электрон. У анион радикала появляется неспаренный электрон на следующем (расположенном выше) энергетическом уровне (рис.3, 2). При взаимодействии радикалов (имеющих противоположный заряд и потому притягивающихся друг к другу) перенос электрона может произойти таким образом, что два электрона окажутся на разных уровнях (рис.3, 4). Последнее означает, что один из ее внешних электронов оказывается не на самом нижнем свободном электронном уровне, как у исходных молекул, а на вышележащем электронном уровне. Такая молекула при переходе в основное состояние испускает квант света (рис.3, 5).
Мы видим, что весь процесс можно разделить на три стадии:
- Восстановление одного из участников реакции (присоединение электрона) и окисление второго (отрыв электрона). Это приводит к запасанию химической энергии в системе, которая позднее выделится в виде фотона.
- Перенос электрона (окислительно-восстановительная реакция) не на самый нижний, а на один из более высоких энергетических уровней и образование, таким образом, продукта реакции в электронно-возбужденном состоянии.
- Высвечивание фотона при переходе молекулы из электронно-возбужденного в основное состояние (люминесценция).
Обычно химические реакции, сопровождающиеся свечением, протекают через целый ряд промежуточных стадий, но основные этапы запасания и высвечивания энергии, в общем, сходны.
Собственное свечение клеток и тканей животных
Отечественный ученый А. Г. Гурвич был первым, кто указал на существование собственного слабого свечения клеток животных и растений, названного им "митогенетическими лучами" [3]. Согласно А. Г. Гурвичу, митогенетические лучи – это очень слабое ультрафиолетовое излучение клеток, которое индуцирует деление окружающих клеток. Хотя сам А. Г. Гурвич использовал для обнаружения лучей только "биологический детектор", т.е. разные делящиеся клетки, его последователи в России (С. Родионов и Г. М. Франк, 1934г.) и за рубежом (R. Aubert, 1938 и другие) разработали физический детектор излучения: газоразрядный счетчик фотонов с кварцевым окном, прозрачным для УФ-лучей. С помощью счетчика фотонов было изучено свечение в ходе ряда окислительно-восстановительных реакций, а также свечение биологических объектов, таких как суспензия дрожжевых клеток, проростки растений и даже нервно-мышечный препарат. Развития эта техника, однако, не получила из-за неустойчивой работы газоразрядных счетчиков и плохой воспроизводимости результатов. В 1952 г. А. Стрелер создал высокочувствительный прибор для счета фотонов на основе фотоэлектронного фотоумножителя (ФЭУ), охлаждаемого жидким азотом, и применил его для изучения послесвечения зеленых листьев. В 1956 году группа итальянских авторов использовала сходную технику для изучения свечения проростков растений. Сверхслабое свечение животных клеток и тканей было изучено в работах автора данной лекции и Ф. Ф. Литвина (1959 г.), Б. Н. Тарусова и сотрудников (1961 г.) также с помощью фотоумножителя, охлаждаемого жидким азотом (см. рис.4а).
В настоящее время созданы высокочувствительные малошумящие ФЭУ, позволяющие без охлаждения регистрировать слабое собственное свечение (хемилюминесценцию) клеток и тканей растений и животных. Это свечение имеет низкую интенсивность, и для ее измерения используют высокочувствительные приборы – хемилюминометры. Схема одного из современных хемилюминометров дана на рис.4б. Раствор или суспензия клеток помещаются в кювету, в которой поддерживается определенная температура и осуществляется перемешивание для лучшего снабжения кислородом. В кювету по ходу опыта вводят различные добавки и отбирают пробы для химического анализа. Свет ХЛ измеряют с помощью чувствительного прибора – фотоумножителя (ФЭУ), электрический сигнал от которого усиливается, а затем обрабатывается и записывается. В настоящее время для обработки и записи сигналов используют персональные компьютеры (ПК). Между компьютером и хемилюминометром включают промежуточный прибор – интерфейс, делающий электрические сигналы от ФЭУ "понятными" для ПК (рис.4в).
Слабое свечение можно изучать не только в растворах или суспензиях клеток, но и на целых органах в составе организма.
Наиболее важные части комплекса – это совершенно непроницаемый для света ящик, в который помещают лабораторное животное, например крысу, и высокочувствительный приемник света – фотоумножитель, соединенный через усилитель и другие промежуточные устройства с самопишущим потенциометром или же персональным компьютером. Аналогичную конструкцию используют для изучения свечения изолированных органов, например, перфузируемого легкого или сердца. Добавляя в перфузионную жидкость ингибиторы или активаторы определенных реакций, можно судить о природе химических реакций, сопровождающихся свечением.
Таким способом было показано, что собственное свечение тканей могут быть ответственны три типа реакций:
- Реакции так называемых активных форм кислорода.
- Реакции цепного (перекисного) окисления липидов.
- Реакции с участием окиси азота.
В следующих разделах будет рассмотрен механизм этих реакций.
Реакции с участием активных форм кислорода
Активными формами кислорода (АФК) обычно называют перекись водорода (H2O2), гипохлорит (ClO-) и кислородные радикалы: супероксид (·OO-) и радикал гидроксила (HO-). Главным источником АФК в организме человека и животных служат клетки-фагоциты: гранулоциты и моноциты крови и тканевые макрофаги(см. рис.5).
Мембраны фагоцитов содержат ферментативный комплекс (НАДФН–оксидазу), который окисляет НАДФН до НАДФ+ за счет восстановления двух молекул кислорода до супероксидного радикала:
| НАДФН + 2O2 -> НАДФ+ + 2O2•– |
При взаимодействии (диспропорционировании) двух супероксидных радикалов образуется перекись водорода и кислород:
Фагоцит выделяет в окружающую среду не только АФК, но и ряд ферментов, среди которых важнейший - миелопероксидаза, катализирующая реакцию образования гипохлорита из аниона хлора и перекиси водорода:
Кроме того, в присутствие ионов металлов переменной валентности, например железа, происходит образование радикалов гидроксила из перекиси водорода (реакция Фентона) и гипохлорита (реакция Осипова):
| H2O2 + Fe2+ -> Fe3+ + HO- + HO· |
| ClO- + Fe2+ + H+ -> Fe3+ + Cl- + HO· |
Таким образом, активированные фагоциты для борьбы с чужеродными клетками образуют целый букет активных форм кислорода, которые, как оказалось, могут взаимодействовать друг с другом и с другими молекулами с испусканием квантов хемилюминесценции.
Собственная хемилюминесценция активированных фагоцитов была открыта Р. Элленом (R. Allen) и сотрудниками в 1972 году.
Непосредственной причиной такого свечения обычно считают образование синглетного кислорода в реакциях между кислородными радикалами, перекисью водорода и гипохлоритом. Действительно известно, что весьма интенсивная хемилюминесценция сопровождает реакцию гипохлорита и перекиси водорода, в которой образуются молекулы кислорода в возбужденном (синглетном) состоянии (1O2):
| ClO- + H2O2 -> Cl- + H2O + 1O2 |
Синглетный кислород переходит в основное (триплетное) состояние кислорода с испусканием кванта света (хемилюминесценции) в инфракрасной области спектра (длина волны 1270 нм).
| 1O2 -> 3O2 + фотон (1270 нм) |
Кроме того, молекулы синглетного кислорода могут образовывать возбужденные димеры (так называемые эксимеры) кислорода, которые переходят в основное состояние с испусканием видимого света (длины волн 635, 580, 535 нм).
Синглетный кислород может, по-видимому, образовываться также при взаимодействии кислородных радикалов:
| •O2- + •O2- + 2H+ -> H2O2 + 1O2 |
| •O2- + HO·+ H+ -> H2O + 1O2 |
Надо отметить, что наряду с реакциями активных форм кислорода, вклад в собственную ХЛ фагоцитов могут вносить реакции цепного окисления липидов и реакции пероксинитрита, о которых пойдет речь ниже.
Свечение при реакциях цепного окисления липидов
Одна из главных составляющих собственной (неактивированной) хемилюминесценции животных клеток и тканей – свечение, сопровождающее цепное окисление липидов в мембранных структурах клеток и липопротеинах крови. Эта реакция идет с участием свободных радикалов липидов L· и липопероксидов LOO·, которые как бы "ведут" цепи окисления (см. рис.6).
Время от времени радикалы, ведущие цепь окисления, взаимодействуют друг с другом. В реакции взаимодействия двух радикалов липопероксида (LOO·) образуются молекулы кетона и кислорода в электронно-возбужденном состоянии, которые затем переходят в основное состояние, испуская квант света (фотон):
| LOO· + LOO· -> LOH + L=O* + 1O2 |
| L=O* -> L=O + hn1 (420–520 нм) |
| 1O2 -> 3O2 + hn2 (1270 нм) |
| 1O2 + 1O2 -> [(O2)2]* (эксимер кислорода) |
| [(O2)2]* -> 2O2 + hn3 (480, 540, 640 нм) |
Чем больше радикалов LOO· в системе, то есть чем энергичнее идут цепные реакции окисления липидов, тем выше интенсивность хемилюминесценции, сопровождающей реакцию радикалов. Вещества, реагирующие со свободными радикалами и тем самым тормозящие цепное окисление липидов (так называемые антиоксиданты), одновременно подавляют хемилюминесценцию. Именно подавление собственной хемилюминесценции тканей и клеток такими антиоксидантами, как например токоферол (витамин Е), указывает на то, что это свечение обусловлено реакциями цепного окисления липидов. С другой стороны, изучая влияние различных природных и синтетических соединений на течение во времени (кинетику) ХЛ, можно судить о способности этих веществ защищать наш организм от вредного действия свободных радикалов и тем самым отбирать кандидатов на определенные лекарства.
Хемилюминесценция в реакциях с участием окиси азота
Окись азота NO – это газ, хорошо растворимый в воде и обладающий высокой реакционной способностью; последнее связано с тем, что NO – свободный радикал (·NO). Любопытно, что само открытие выделения окиси азота клетками человека и животных было сделано в 1984 году методом хемилюминесценции, правда не в растворе, а в газовой фазе. При смешивании окиси азота и озона наблюдается яркая хемилюминесценция, и в восьмидесятые годы газовые хемилюминометры для определения окиси азота выпускались в промышленном масштабе. К концу восьмидесятых годов биологическая роль окиси азота уже ни для кого не была секретом. Его первая расшифрованная функция – расслабление стенок кровеносных сосудов (вазодилатация), которое в свою очередь приводит к улучшению кровоснабжения органов и снижению общего кровяного давления. Вскоре оказалось, что окись азоты выделяется клетками-фагоцитами и участвует в борьбе с организма-хозяина с микроорганизмами. Сейчас хорошо известно, что окись азота выделяется очень многими типами клеток и является одним из основных регуляторов внутриклеточных процессов. Но это – тема отдельного разговора.
Участие реакций нитроксида в собственной хемилюминесценции тканей животных было показано в опытах Джулио Терренса и сотрудников, которые изучали свечение перфузируемого легкого. Оказалось, что свечение снижается очень существенно (на 85%!) при введении в перфузат нитро-L-аргинина, ингибитора NO-синтазы (фермента, катализирующего образование окиси азота в живых клетках). Свечение удавалось наблюдать также и в растворах, содержащих окись азота, супероксидные радикалы и какой-нибудь белок. Между тем известно, что при реакции окиси азота и супероксида образуется пероксинитрит, соединение, кстати сказать, очень токсичное;
| •N=O + •O-O- + H+ -> O=N-O-OH (пероксинитрит) |
По-видимому, именно реакция пероксинитрита с белком приводит к свечению, которое вносит существенный вклад в свечение всего органа.
Надо заметить, что природа процессов, определяющих собственное свечение тканей, может меняться при изменении состояния этой ткани. В опытах того же автора было показано, что у животных с воспалением легких ингибитор NO-синтазы слабо влиял на свечение органа, зато свечение снижалось антиоксидантами – супероксиддисмутазой и ловушками липидных радикалов. Логичен сделанный вывод, что при воспалении на первый план выходят реакции, связанные с активацией клеток-фагоцитов и образованием ими активных форм кислорода, а затем – липидных перекисей, тогда как в норме за свечение ответственны реакции окиси азота.
Таким образом, собственное свечение ткани обусловлено реакциями трех типов (рис.7).
Почему оно «сверхслабое», это свечение клеток и тканей?
Чем же объясняется низкая интенсивность хемилюминесценции, сопровождающей реакции свободных радикалов?
Причин целых три. Во-первых, сама концентрация радикалов в биологических системах очень мала из-за их высокой химической активности, поэтому малы и скорости реакций, сопровождающихся свечением. Во-вторых, не всякое химическое взаимодействие радикалов непременно приводит к образованию электронно-возбужденных молекул продуктов реакции, как это изображено на рис.3 (4). Напротив, в подавляющем большинстве окислительно-восстановительных взаимодействий между молекулами или радикалами электрон переносится не на уровень возбужденного состояния, а на самый нижний свободный уровень, и последующего высвечивания кванта не происходит. В третьих, даже если и образовалась возбужденная молекула продукта, вероятность того, что высветится квант, а не произойдет растраты энергии в тепло, тоже обычно очень мала. Две последние причины приводят к тому, что квантовый выход хемилюминесценции в случае, скажем, реакции двух перекисных радикалов составляет всего 10-8-10-10. Это происходит потому, что квантовый выход образования возбужденных молекул продукта
равен всего 10-4-10-5, а квантовый выход люминесценции продукта
составляет для кетонов, образующихся при взаимодействии перекисных радикалов, в свою очередь, тоже около 10-4-10-5. Вот и выходит, что общий квантовый выход хемилюминесценции составляет всего-навсего QХЛ = QВОЗБ · QЛЮМ = 10-8-10-10. Отсюда становится понятной стратегия для использования хемилюминесценции как метода обнаружения радикалов. Для усиления свечения, т.е. QХЛ, надо величить или QВОЗБ или QЛЮМ или и то и другое. Соединения, которые реагируют с радикалами с образованием возбужденных молекул продуктов, такие как люминол или люцигенин, называют химическими активаторами ХЛ, или хемилюминогенными зондами. Они как бы увеличивают QВОЗБ. Существуют и такие вещества, которые перехватывают возбужденные состояния продуктов и высвечивают кванты с высоким выходом (т.е. как бы увеличивают QЛЮМ); их можно назвать физическими активаторами ХЛ.
Подробнее об активации хемилюминесценции см. в лекции №10.
Применение собственной (неактивированной) хемилюминесценции
Возможности лабораторного клинического анализа
Почти сразу после того, как появились первые работы по собственной "сверхслабой" хемилюминесценции клеток и тканей, были сделаны попытки использовать этот показатель в целях клинической диагностики. По понятным причинам первым объектом была цельная кровь и плазма крови больных людей. Поскольку собственное свечение было очень слабым и измерять его было трудно, было сделано много попыток усилить это свечение: к плазме крови добавляли красители, перекись водорода, ионы двухвалентного железа и т. д. [4]. Природа химических реакций, обуславливающих свечение, был понята далеко не всегда, но авторов предложений это не слишком беспокоило: лишь бы была разница между больными и здоровыми, а еще лучше – между разными группами больных. Скорее удивительно, что при ряде патологий разница была довольно существенной. Пожалуй наибольшее число публикаций в литературе посвящено свечению плазмы крови, к которой для инициирования цепного окисления липидов добавляли соли двухвалентного железа. Амплитуда сигнала хемилюминесценции хорошо коррелировала с количеством продуктов перекисного окисления липидов, определяемых химическим методом, и зависела от липидного состава плазмы крови и концентрации в ней антиоксидантов, т.е. веществ, тормозящих процессы, идущие с участием свободных радикалов. Во многих случаях данные таких анализов были признаны ценными в качестве дополнительных при постановке врачом диагноза заболевания, контроля за эффективностью лечения и прогноза течения болезни. И все же измерение неактивированной хемилюминесценции в широкую клиническую практику пока не вошло, в отличие от хемилюминесценции в присутствии активаторов.
Изучение механизма цепных реакций
Вот уж где польза от измерения неактивированной хемилюминесценции несомненна – так это при изучении механизма цепного окисления липидов в мембранах и липопротеинах плазмы крови. Реакции цепного окисления отличаются большой сложностью и включают в себя целый ряд быстропротекающих стадий. Главные участники реакций, свободные радикалы, обычными методами химического анализа определены быть не могут из-за своей чрезвычайно высокой реакционной способности, а следовательно – неустойчивости в биохимических системах. Между тем измерение хемилюминесценции как раз и позволяет оценивать концентрацию липидных радикалов, ведущих цепи окисления. Интенсивность хемилюминесценции при цепном окислении (пероксидации) липидов равна скорости образования фотонов в реакции:
| LOO· + LOO· -> молекулярные продукты + фотон |
Скорость самой реакции (т.е. число молей продукта, образующегося в секунду) по закону действующих масс равна:
где k – константа скорости реакции взаимодействия радикалов.
Следовательно, интенсивность свечения (в числе молей фотонов в секунду) равна:
где QХЛ – квантовый выход хемилюминесценции.
Таким образом, интенсивность свечения однозначно отражает концентрацию свободных радикалов, ведущих цепи окисления липидов, в каждый данный момент времени, что представляет собой бесценную информацию для анализа механизма реакций на основе измерений кинетики (т.е. временного хода) хемилюминесценции. Типичная кривая кинетики хемилюминесценции (ХЛ) приведена на рис.8.
Различают несколько стадий процесса, каждая из которых определяется определенными реакциями цепного процесса пероксидации: FF – быстрая вспышка ХЛ, LP – латентный период, SF – медленная вспышка ХЛ, SL – стационарное свечение [5]. Математический анализ такого рода кинетических кривых лежит в основе изучения механизма цепных реакций окисления, которые отличаются большой сложностью.
В этом опыте к суспензии митохондрий добавляли ионы двухвалентного железа для запуска реакций цепного окисления липидов. Наряду с измерением хемилюминесценции (ХЛ), определялось накопление продуктов липидной пероксидации (в данном опыте измерялась концентрация производных малонового диальдегида, MDA) и контролировалось снижение концентрации ионов Fe2+, добавленных к суспензии. Хорошо видно, что кинетические кривые отличаются большой сложностью, что отражает сложность самого процесса. Подробнее о механизме этих реакций сказано в лекции «Свободные радикалы в биологических системах». В случае Fe2+–индуцированной ХЛ в суспензиях мембранных везикул (липосомы, митохондрии, мембраны эндоплазматического ретикулума, клеточные мембраны) кривые ХЛ очень сходны.
В итоге мы теперь знаем основные реакции, приводящие к свечению, а также константы скоростей основных стадий самого процесса цепного окисления липидов в биологических мембранах, т.е. стадии инициирования, продолжения цепей, их разветвления или обрыва, как спонтанного, так и в присутствии разных антиоксидантов. Можно уверенно сказать, что все эти знания в значительной мере были получены благодаря измерениям хемилюминесценции, сопровождающей цепное окисление липидов.
Заключение
С развитием техники измерения очень слабых световых потоков стало ясно, что свечение при химических реакциях (хемилюминесценция) – не такая уж экзотика. Слабое свечение сопровождает по существу все химические реакции, идущие с участием свободных радикалов. Собственное свечение животных клеток и тканей обусловлено преимущественно реакциями цепного окисления липидов и реакциями, сопровождающими взаимодействие окиси азота и супероксидного радикала. В присутствии определенных соединений, обычно называемых в отечественной литературе "активаторами", свечение клеток и тканей может быть усилено на несколько порядков величины.
Есть нечто романтическое в том, что наши клетки и ткани могут излучать свет, когда работают. Наверное это было побудительной причиной для автора заняться изучением собственного свечения животных тканей сорок лет тому назад. Увы, действительность оказалась иной. Свечение отражает процессы, скорее вредные для организма: в его основе лежат реакции радикалов, которые обладают способностью разрушать клеточные структуры и приводить к развитию болезней человека. В самом этом факте нет ничего удивительного. Свечение связано с выделением большого количества энергии в химической реакции, в которую вступают очень реакционноспособные частицы – свободные радикалы. Но именно в силу высокой химический активности эти же радикалы способны повреждать молекулы и клетки.
По этой причине за последние годы исследование хемилюминесценции, сопровождающей биохимические реакции в живых клеток, сместилось из области "чистой" биологии в область медицины. В развитии многих патологических состояний в нашем организме принимают непосредственное участие свободные радикалы кислорода, липидов и белков, а также реакции радикалов с окисью азота. Все эти реакции сопровождаются хемилюминесценцией, изучение которой помогает вникнуть в механизм этих реакций, а значит – поможет понять, как их контролировать.
Вопросы для самоконтроля
- Молекулярные механизмы образования возбужденного состояния молекулы при реакциях свободных радикалов
- Квантовый выход хемилюминесценции. Что Вы о нем знаете?
- Применение хемилюминесценции, сопровождающей образование клетками активных форм кислорода, в клиническом лабораторном анализе.
- Хемилюминесценция, сопровождающая цепное окисление липидов. Механизм реакций. Изучение кинетики реакций цепного окисления липидов методом хемилюминесценции.
Рекомендуемая литература
- Владимиров Ю.А. Сверхслабые свечения при биохимических реакциях. М., Наука, 1966.
- Владимиров Ю.А., Потапенко А.Я. Физико-химические основы фотобиологических процессов. М. Высшая школа, 1989.
- Гурвич А.Г. Митогенетическое излучение, М., Госмедиздат, 1934.
- Владимиров, Ю.А. и Арчаков, А.И. Перекисное окисление липидов в биологических мембранах, Москва, Наука, 1972.
- Владимиров Ю.А., Шерстнев М.П. Хемилюминесценция клеток животных. Итоги Науки и Техники, Сер. Биофизика, том. 24, Москва, ВИНИТИ, 1989.
ПОКАЗАТЬ ПЛАНПЕРЕЙТИ В НАЧАЛО