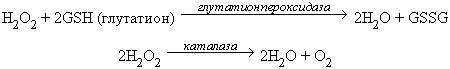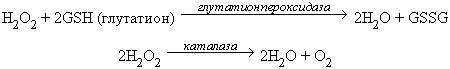ПОКАЗАТЬ ПЛАНПЕРЕЙТИ В КОНЕЦ
Лекция 5
Перекисное окисление липидов
Повреждение компонентов биологических мембран при патологических процессах
Биологические мембраны наряду с элементами цитоскелета формируют ультраструктуру протоплазмы. Кроме того, они выполняют множество функций, нарушение любой из которых может привести к изменению жизнедеятельности клетки в целом и даже к ее гибели. На рис.1 дано схематическое изображение типичной мембраны с указанием тех ее элементов, повреждение которых может иметь место в патологии и лежать в основе развития различных заболеваний.
Наиболее тяжелые последствия вызывает повреждение липидного слоя (или бислоя) мембран. Липидный слой клеточной и внутриклеточных мембран выполняет две основные функции - барьерную и матричную (структурную). Повреждение барьера приводит к нарушению регуляции внутриклеточных процессов и тяжелым расстройствам клеточных функций. С другой стороны, липидный слой мембран формирует в клетке особую жидкую фазу. На поверхности раздела водной и липидной фаз, а также внутри липидной фазы "плавают" многочисленные ферменты, многие субстраты биохимических реакций, белковые клеточные рецепторы, гликолипиды и гликолипопротеиды, образующие гликокаликс. Во многих клетках до 80% белков встроены в мембраны или связаны с их поверхностью. Липидный бислой выполняет, таким образом, роль структурной основы или матрицы для всех этих белковых, липопротеидных, гликопротеидных и гликолипидных компонентов мембран. От свойств липидной фазы мембран, таких, как вязкость, поверхностный заряд, полярность, зависит работа мембранных ферментов и рецепторов.
Наличие гликокаликса характерно для наружных клеточных мембран. Он выполняет ряд функций, в частности, от него зависят свойства клеточной поверхности, способность клеток к фагоцитозу и адгезии с другими клетками. Гликокаликс эритроцитов препятствует их агглютинации. Повреждение гликокаликса приводит к тяжелым последствиям, помимо прочего еще и потому, что это приводит к изменению иммунных свойств клеточной поверхности.
Действие многих токсических соединений направлено на белковые компоненты клеточной мембраны. Например, цианистый калий блокирует цитохромоксидазу - фермент, входящий в состав внутренних мембран митохондрий. Ионы тяжелых металлов (ртуть, серебро, свинец) связывают SH-группы белков, в том числе мембранных ферментов и ионных каналов, вызывая их инактивацию. На белки плазматических мембран или элементы цитоскелета направлено действие многих бактериальных токсинов. Изменения в активности мембранных ферментов, каналов и рецепторных белков, вызванные неблагоприятными факторами, также приводят к нарушению функции клеток и развитию заболеваний.
Основные механизмы нарушения барьерных свойств липидного слоя
Изучение воздействия разного рода повреждающих агентов на изолированные клетки (например, эритроциты), митохондрии, фосфолипидные везикулы (липосомы), плоские бислойные липидные мембраны (БЛМ) и другие модельные объекты показало, что, в конечном счете, существует всего четыре основных процесса, которые непосредственно обусловливают нарушение целостного липидного бислоя в патологии [Владимиров Ю. А., 1973]:
- перекисное окисление липидов;
- действие мембранных фосфолипаз;
- механическое (осмотическое) растяжение мембраны;
- адсорбция на бислое полиэлектролитов, включая некоторые белки и пептиды.
Чтобы понять роль этих процессов в развитии патологического состояния, надо знать химические и физические условия протекания каждого из них, пути их регуляции в живой клетке и причины ее нарушения, характер повреждения свойств мембран под действием данного процесса, биологические последствия такого повреждения мембран для жизнедеятельности клетки и организма в целом. Рассмотрим эти вопросы на примере наиболее изученного процесса – перекисного окисления (пероксидации) липидов.
Свободнорадикальное (перекисное) окисление липидов
Реакции, в которых образуются свободные радикалы
См. также соответствующий раздел в лекции №7.
Перекисное окисление (пероксидация) липидов - пример процесса, идущего с участием свободных радикалов. Свободные радикалы - это молекулярные частицы, имеющие непарный электрон на внешней орбитали и обладающие высокой реакционной способностью. Их изучение ведется методом ЭПР (спиновые ловушки), хемилюминесценции и путем применения ингибиторов реакций, в которых участвуют радикалы определенного типа.
В таблице 1 дан перечень основных типов свободных радикалов, образующихся в организме человека.
Таблица 1. Свободные радикалы, образующиеся в клетках нашего организма
| Радикал |
Основной источник |
Вредные реакции |
| Первичные радикалы: |
| Семихиноны |
Цепи переноса электронов |
HQ· + O2 -> Q+ ·O2- + H+ |
| Супероксид |
Клетки-фагоциты |
·O2- + Fe3+ -> O2 + Fe2+ |
| Монооксид азота(NO) |
Клетки эндотелия и многие другие |
NO· + ·O2- -> OONO- (пероксинитрит) |
| Вторичные радикалы: |
| Радикал гидроксила |
H2O2 + Fe2+ -> Fe3+ + HO- + HO· (реакция Фентона)
HOCl + Fe2+ -> Fe3+ + Cl- + HO· (реакция Осипова) |
Повреждение ДНК и РНК, цепное окисление липидов |
| Радикалы липидов |
Цепное окисление липидов |
Повреждение липидного бислоя и мембранных ферментов |
| Радикалы антиоксидантов |
Цепное окисление липидов |
Иногда оказывают прооксидантное действие |
| Радикалы, обрзующиеся при метаболизме ксенобиотиков |
Промышленные токсины инекоторые лекарства |
Образование вторичных радикалов |
| Радикалы, образующиеся при действии света |
Поглощающие свет вещества |
Образование вторичных радикалов |
Первичные радикалы
Основные радикалы, образующиеся в клетках - это радикалы кислорода (супероксид и гидроксильный радикал), монооксид азота, радикалы ненасыщенных жирных кислот, радикалы, образующиеся в окислительно-восстановительных реакциях (например, убихинол). Радикалы образуются также при действии ультрафиолетовых лучей и в ходе метаболизма некоторых чужеродных соединений (ксенобиотиков), в том числе некоторых препаратов, одно время применявшихся в качестве лекарств.
Активные формы кислорода
Основная масса молекулярного кислорода, потребляемого клетками нашего организма, непосредственно восстанавливается до воды, окисляя органические субстраты в цепях переноса электронов. Меньшая часть кислорода расходуется на неполное окисление органических соединений. Наконец, заметная часть кислорода восстанавливается клетками нашего организма до супероксидного радикала. Так клетки – фагоциты (моноциты и гранулоциты крови и тканевые макрофаги) выделяют супероксид в реакции, катализируемой ферментным комплексом – НАДФН-оксидазой:
| НАДФН + 2O2 -> НАДФ+ + 2O•- (супероксид) |
Дальнейшая судьба супероксидных радикалов может быть разной (см. схему на рис.2).
В норме и при отсутствие ионов металлов переменной валентности супероксидные радикалы превращаются в перекись водорода; эта реакция катализируется ферментом супероксиддисмутазой (СОД) (реакция 2 на рис.2):
Клетки-фагоциты используют перекись водорода, превращая ее в гипохлорит – соединение, разрушающее стенки бактериальных клеток; эта реакция катализируется ферментом миелопероксидазой (реакция 3 на рис.2):
Избыток перекиси водорода удаляется под действием двух ферментов: глутатионпероксидазы или каталазы (реакция 4 на рис.2):
В условиях патологии могут произойти нарушения либо системы защитных ферментов (в частности, снижение активности СОД), либо ферментных систем, связывающих ионы железа в плазме крови (церулоплазмин и трансферрин) и в клетках (ферритин). В этом случае супероксидные радикалы и перекись водорода вступают в альтернативные реакции:
Образование двухвалентного железа из трехвалентного (реакция 7 на рис.2):
Реакция перекиси водорода и гипохлорита с ионами двухвалентного железа (реакции 9 и 10 на рис.2):
| Fe2+ + H2O2 -> Fe3+ + HO- + HO· (радикал гидроксила) |
| Fe2+ + ClO- + H+ -> Fe3+ + Cl- + HO· (радикал гидроксила) |
Совокупность продуктов, образуемых активированными клетками-фагоцитами (радикалы супероксида и гидроксила, перекись водорода и гипохлорит) называют активными формами кислорода; некоторые авторы называют гипохлорит и продукты его метаболизма в тканях (такие как хлорамины R-NHCl) называют активными формами хлора.
Радикалы гидроксила химически исключительно активны и вызывают повреждение белков, нуклеиновых кислот и липидов биологических мембран. Особенно тяжелые последствия имеют две последние реакции. Радикалы ·OH вызывают разрыв нитей ДНК, обладая, в зависимости от ситуации, мутагенным, канцерогенным или цитостатическим действием. С другой стороны, реагируя с ненасыщенными жирными кислотами, входящими в состав мембранных липидов, радикалы гидроксила инициируют цепную реакцию их пероксидации (перекисного окисления).
Цепное окисление липидов
См. также соответствующий раздел в лекции №7.
См. также лекцию «Кинетика реакций цепного окисления липидов».
Реакция цепного окисления липидов играет исключительную роль в клеточной патологии, и следует остановиться на ее механизме. Она протекает в несколько стадий, которые получили название инициирование, продолжение, разветвление и обрыв цепи (см. рис.3 и 4). Рассмотрим эти стадии подробнее.
Инициирование цепи
Радикал гидроксила, будучи небольшой по размеру незаряженной частицей, способен проникать в толщу гидрофобного липидного слоя и вступать в химическое взаимодействие с полиненасыщенными жирными кислотами (которые принято обозначать как LH), входящими в состав биологических мембран и липопротеинов плазмы крови. При этом в липидном слое мембран образуются липидные радикалы:
Липидный радикал (L·) вступает в реакцию с растворенным в среде молекулярным кислородом; при этом образуется новый свободный радикал - радикал липоперекиси (LOO·):
Продолжение цепи
Радикал LOO· атакует одну из соседних молекул фосфолипида с образованием гидроперекиси липида LOOH и нового радикала L·:
Чередование двух последних реакций как раз и представляет собой цепную реакцию перекисного окисления липидов (см. рис.3).
Разветвление цепи
Существенное ускорение пероксидации липидов наблюдается в присутствии небольших количеств ионов двухвалентного железа. В этом случае происходит разветвление цепей в результате взаимодействия Fe2+ c гидроперекисями липидов:
| Fe2+ + LOOH -> Fe3+ + HO- + LO· |
Образующиеся радикалы LO· инициируют новые цепи окисления липидов (рис.4):
| LO· + LH -> LOH + L·; |
| L· + O2 -> LOO· -> и т. д. |
Обрыв цепей
В биологических мембранах цепи могут состоять из десятка и более звеньев. Но в конце концов цепь обрывается в результате взаимодействия свободных радикалов с антиоксидантами (InH), ионами металлов переменной валентности (например, теми же Fe2+) или друг с другом:
| LOO· + Fe2+ + H+ -> LOOH + Fe3+ |
| LOO· + InH -> In· + LOOH |
| LOO· + LOO· -> молекулярные продукты + фотон |
Хемилюминесценция как метод изучения реакций, идущих с участием свободных радикалов
См. также лекцию №9.
Последняя реакция интересна еще и тем, что она сопровождается свечением (хемилюминесценцией). Интенсивность этой хемилюминесценции (ХЛ) очень мала, поэтому ее иногда называют "сверхслабым свечением". Интенсивность свечения пропорциональна квадрату концентрации свободных радикалов в мембранах, а скорость перекисного окисления прямо пропорциональна концентрации тех же радикалов. Поэтому интенсивность "сверхслабого" свечения однозначно отражает скорость липидной пероксидации в изучаемом биологическом материале, и измерение хемилюминесценции довольно часто используется при изучении перекисного окисления липидов в различных объектах.
Измерение хемилюминесценции широко применяется также для изучения образования активных форм кислорода клетками крови и перитонеальными макрофагами. В присутствии специальных соединений – люминола и люцигенина – наблюдается хемилюминесценция изолированных лейкоцитов крови, макрофагов или просто разведенной цельной крови, если клетки-фагоциты продуцируют гипохлорит и радикалы кислорода (супероксид + гидроксил-радикал). Интенсивность хемилюминесцентных ответов клеток увеличивается в несколько раз при появлении очагов некроза в организме, например, после инфаркта миокарда, и напротив, угнетается при тканевой гипоксии; поэтому измерение клеточной хемилюминесценции может быть использовано в ряде случаев с целью выявления заболевания, оценки тяжести состояния больного и эффективности назначенного лечения.
Биологические последствия пероксидации липидов
См. также соответствующий раздел в лекции №7.
Увеличенное образование свободных радикалов в организме и связанное с этим усиление процессов пероксидации липидов (которое иногда называют "оксидативным стрессом") сопровождается рядом нарушений в свойствах биологических мембран и функционировании клеток. В таблице 2 приведены наиболее важные изменения в мембранных структурах при перекисном окислении липидов.
Таблица 2. Наиболее важные изменения в мембранных структурах при перекисном окислении липидов
| Действие перекисного окисления на мембранные белки |
Действие перекисного окисления на липидный слой мембран |
Окисление тиоловых соединений
Повреждение переносчиков
Появление проницаемости для ионов
Повреждение транспортных АТФаз |
Увеличение микровязкости мембран
Изменение поверхностного заряда мембран и липопротеинов
Уменьшение гидрофобного объема
Увеличение полярности липидной фазы
Увеличение проницаемости для ионов водорода
Увеличение проницаемости для ионов кальция |
Окисление тиоловых групп мембранных белков
Этот процесс может приводить в результате к неферментативной реакции SH-групп со свободными радикалами липидов; при этом образуются сульфгидрильные радикалы, которые затем взаимодействуют с образованием дисульфидов либо окисляются кислородом с образованием производных сульфоновой кислоты:
| Pr-SH + L· -> LH + Pr-S· |
| Pr1-S· + Pr2-S· -> Pr1-SS- Pr2 |
| Pr-S· + O2 -> Pr-SO2· -> производные сульфоновой кислоты |
Связанное с перекисным окислением липидов окисление белков и образование белковых агрегатов в хрусталике глаза заканчивается его помутнением; этот процесс играет важную роль в развитии старческой и других видов катаракты у человека.
Большую роль в патологии клетки играет также инактивация ион-транспортных ферментов, в активный центр которых входят тиоловые группы, в первую очередь Ca2+-АТФазы. Инактивация этого фермента приводит к замедлению "откачивания" ионов кальция из клетки и, наоборот, к входу кальция в клетку, увеличению внутриклеточной концентрации ионов кальция и повреждению клетки.
Наконец, окисление тиоловых групп мембранных белков приводит к появлению дефектов в липидном слое мембран клеток и митохондрий. Под действием разности электрических потенциалов на мембранах через такие поры в клетки входят ионы натрия, а в митохондрий - ионы калия. В результате происходит увеличение осмотического давления внутри клеток и митохондрий и их набухание. Это приводит к еще большему повреждению мембран.
Изменение свойств липидного слоя
Увеличение микровязкости мембран
Изменение поверхностного заряда мембран и липопротеинов
Уменьшение гидрофобного объема
Увеличение полярности липидной фазы
Увеличение проницаемости для ионов водорода
Увеличение проницаемости для ионов кальция
Увеличение проницаемости для ионов кальция – второй результат перекисного окисления липидов – связано с тем, что продукты пероксидации обладают способностью непосредственно увеличивать ионную проницаемость липидного бислоя.
Так показано, что продукты перекисного окисления липидов делают липидную фазу мембран проницаемой для ионов водорода и кальция. Это приводит к тому, что в митохондриях окисление и фосфорилирование разобщаются, а клетка оказывается в условиях энергетического голода (т.е. недостатка АТФ). Одновременно в цитоплазму выходят ионы кальция, которые повреждают клеточные структуры.
Третий (и быть может, самый важный) результат пероксидации – это уменьшение стабильности липидного слоя, что может привести к электрическому пробою мембраны собственным мембранным потенциалом, т.е. под действием разности электрических потенциалов, существующей на мембранах живой клетки. Электрический пробой приводит к полной потере мембраной ее барьерных функций.
Клеточные системы антирадикальной защиты
В нормальных условиях процесс перекисного окисления липидов находится под строгим контролем ферментативных и неферментативных систем клетки, от чего скорость его невелика. Принято делить химические соединения и физические воздействия, влияющие на скорость перекисного окисления липидов, на прооксиданты (усиливают процессы перекисного окисления) и антиоксиданты (тормозят перекисное окисление липидов). К прооксидантам в живой клетке относятся высокие концентрации кислорода (например, при длительной гипербарической оксигенации больного), ферментные системы, генерирующие супероксидные радикалы (например, ксантиноксидаза, ферменты плазматической мембраны фагоцитов и др.), ионы двухвалентного железа.
Хотя сам процесс перекисного окисления развивается в виде цепных реакций в липидной фазе мембран и липопротеинов, начальные (а возможно, и промежуточные) стадии этой сложной системы реакций протекают в водной фазе. Часть защитных систем клетки также локализуется в липидной фазе, а часть - в водной фазе. В зависимости от этого можно говорить о водорастворимых и гидрофобных антиоксидантах. В таблице 3 приведены наиболее известные антиоксиданты.
Таблица 3. Наиболее известные антиоксиданты
| Антиоксидант |
Действие |
| Церулоплазмин (плазма крови) |
Окисляет Fe2+ до Fe3+ молекулярным кислородом |
| Апо-белок трансферрина (плазма крови) |
Связывает Fe3+ |
| Ферритин (цитоплазма) |
Окисляет Fe2+ и депонирует Fe3+ |
| Карнозин |
Связывает Fe2+ |
| Супероксиддисмутазы (повсеместно) |
Удаляет супероксид с образованием пероксида водорода |
| Каталаза (внутри клеток) |
Разлагает пероксид водорода с выделением кислорода |
| Глутатион-пероксидазы (в цитоплазме) |
Удаляет пероксид водорода за счет окисления глутатиона
Удаляет гидроперекиси липидов |
| Глутатионредуктаза |
Восстанавливает окисленный глутатион |
| Токоферол, тироксин, стероиды |
Перехватывают радикалы липидов |
| Аскорбиновая кислота |
Регенерирует окисляющиеся токоферол и убихинон |
| Глутатион |
Используется для восстановления пероксидов |
Антиоксиданты водной фазы
Основные реакции в водной фазе, предшествующие цепному окислению, и роль антиоксидантов в ограничении скорости этих процессов можно представить в виде схемы, приведенной на рис.5.
Непосредственными предшественниками гидроксильного радикала, инициирующего цепное окисление липидов, служат ионы двухвалентного железа и перекись водорода (или образующийся из нее гипохлорит). По этой причине образование радикала гидроксила и пероксидация липидов тормозится веществами, снижающими концентрацию одного из этих двух соединений. К ним относятся:
- Фермент супероксиддисмутаза, который снижает концентрацию супероксидных радикалов и тем самым препятствует восстановлению ими ионов трехвалентного железа до двухвалентного. В клетке ионы железа хранятся в трехвалентном состоянии в специальных депо, образованных субъединицами белка ферритина.
- Ферменты каталаза и глутатион-пероксидаза, которые удаляют перекись водорода. Эффективность работы глутатион-пероксидазы зависит от концентрации свободного глутатиона, при снижении которой может возрастать концентрация цитотоксических гидроксильных радикалов.
Регенерация восстановленного глутатиона (GSH) из окисленного (GSSG) осуществляется за счёт НАДФН; этот процесс катализируется ферментом глутатионредуктазой. Недостаток глутатиона в клетках, например эритроцитах, который может быть обусловлен действием токсических веществ, например ионами тяжелых металлов или наследственным недостатком глутатионредуктазы приводит к активации перекисного окисления; это, в частности, наблюдается при некоторых видах гемолитических анемий.
- Соединения, связывающие ионы железа (комплексоны). Надо, правда, оговориться, что в водной фазе некоторые комплексы ионов железа вступают в реакции с супероксидным радикалом и перекисью водорода наряду со свободными ионами железа в растворе.
Антиоксиданты, тормозящие развитие цепных реакций в липидной фазе
Основные реакции в липидной фазе биологических мембран и липопротеинов крови, а также место действия антиоксидантов в ограничении скорости этих процессов можно продемонстрировать с помощью схемы, приведенной на рис.6:
Цепные реакции "ведут" свободные радикалы липидов (L· и LOO·), разветвление цепей происходит при взаимодействии продукта пероксидации – гидроперекиси липидов (LOOH) с ионами Fe2+. Все соединения, снижающие концентрацию перечисленных веществ, выполняют функцию антиоксидантов. Сюда относятся:
- Ферменты фосфолипаза и глутатионпероксидаза, которые разрушают гидроперекиси липидов, предотвращая разветвление цепей окисления липидов в мембранах. При этом действие фосфолипазы заключается в отщеплении от фосфолипидов окисленной жирной кислоты, содержащей гидроперекисную группу (LOOH), а действие глутатионпероксидазы сводится к восстановлению этой группы до спиртовой с одновременным окислением глутатиона (GSH) до дисульфида (GSSG):
| LOOH + 2GSH -> LOH + GSSG + H2O |
- Ловушки радикалов, которые называют иногда "липидными антиоксидантами". По своей химической природе липидные антиоксиданты - это производные фенола. К ним относится a-токоферол (витамин Е), убихинон (коэнзим Q), тироксин и синтетические соединения, например ионол (бутилированный гидрокситолуол) (см. рис.7).
- Соединения, связывающие железо. Большинство из них, включая такие природные соединения как дипептид карнозин, не просто связывают железо, но, самое главное, не дают ему возможности приникнуть в липидную фазу мембран, поскольку образующиеся комплексы, в силу своей полярности, не проникают в гидрофобную зону.
Для детоксикации двухвалентного железа в организме существует, по-видимому, целая система окисления и связывания ионов железа. В плазме крови эта система представлена ферментом церрулоплазмином (феррооксидазой), который окисляет Fe2+ до Fe3+ кислородом без образования свободных радикалов, и белком трансферрином, который связывает и переносит в кровяном русле ионы трехвалентного железа, которые затем захватывается клетками. В клетках железо может восстанавливаться аскорбиновой кислотой и другими восстановителями, но затем окисляется и депонируется в окисленной форме внутри ферментного белкового комплекса ферритина.
Вопросы для самоконтроля
- Мембранные структуры, повреждаемые при действии неблагоприятных факторов. Основные механизмы нарушения барьерных свойств мембран в патологии.
- Свободные радикалы. Определение и классификация.
- Происхождение и метаболизм супероксид-радикала.
- Происхождение и действие на клеточные структуры радикала гидроксила.
- Основные реакции цепного окисления липидов.
- Действие процесса перекисного окисления липидов на клеточные структуры (белки и липиды) – перечислить.
ПОКАЗАТЬ ПЛАНПЕРЕЙТИ В НАЧАЛО