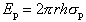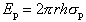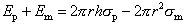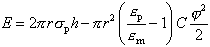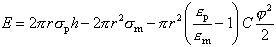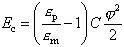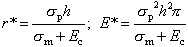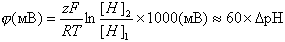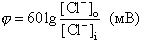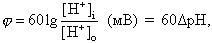ПОКАЗАТЬ ПЛАНПЕРЕЙТИ В КОНЕЦ
Лекция 6
Электрический пробой мембран
Явление электрического пробоя
Электрические свойства липидного слоя мембран удобнее всего изучать на модельных фосфолипидных мембранах, известных под названием БЛМ (бимолекулярная липидная мембрана). На рис.1 приведены основные этапы приготовления БЛМ.
А – приготовление мембраны. В стеклянный (или кварцевый) стакан (1) с раствором электролита (например, 150 мМ KCl) вставлен второй стаканчик из тефлона (2). В стенке тефлонового стакана просверлено отверстие диаметром около 1 мм с заостренными краями (А, 3 и Б). С помощью капилляра (4) в отверстие вводят капельку раствора фосфолипида в гептане или гексане (5).
Б – Вид капли в отверстии тефлонового стакана при большем увеличении. Заметим, что на поверхности капли молекулы фосфолипидов образуют монослой, в котором полярные группы фосфолипидов выставлены наружу, в водную фазу, а гидрофобные хвосты жирных кислот погружены в органический растворитель.
В – Постепенно растворитель уходит по стенкам тефлонового стакана и испаряется с поверхности раствора. Капля истончается, монослои липидов на поверхности линзы, образуемой раствором фосфолипида, сближаются. При освещении спереди на этом месте появляются интерференционные полосы. Мембрана на какое-то время становится "цветной". В конце концов, монослои тесно сближаются и образуют бислойную (бимолекулярную) липидную мембрану. Толщина бислойной мембраны (около 5 нм) намного меньше длины волны видимого света (400 – 700 нм). Интерференция исчезает, и мембрана выглядит как "черная дыра" на фоне белой тефлоновой стенки. Поэтому её называют "черной мембраной". (Первоначальная английская аббревиатура BLM означала Black Lipid Membrqane).
Г – Схематическое изображение бислойной липидной мембраны в отверстии тефлонового стакана (вид сбоку).
Если к бислойной фосфолипидной мембране прикладывать определенную разность потенциалов j, через неё пойдет ток i , причем при малых j зависимость между i и j будет линейной (см. рис.2).
При постоянном потенциале в пределах линейной вольтамперной характеристики ток будет постоянным по времени. Однако при больших потенциалах j ток через мембрану начинает расти, и если не сбросить потенциал, его самопроизвольный рост приведет, в конце концов, к механическому разрушению мембраны.
Электрический пробой мембраны часто изучают, прикладывая к ней кратковременные импульсы потенциала и измеряя последующую электропроводность. Следует отметить, что при небольших длительностях импульса (менее 10 с) потенциал, вызывающий пробой увеличивается с уменьшением длительности импульса (см. рис.3).
В этих условиях само понятие "потенциал пробоя" становится условным. Когда же к мембране прикладывают постоянное напряжение, потенциал пробоя становится вполне понятной величиной: это потенциал, при котором начинается самопроизвольный рост тока, заканчивающийся разрушением мембраны.
Теория электрического пробоя
Было предложено несколько теорий электрического пробоя, из которых мы остановимся только на теории Ю. А. Чизмаджева, поскольку она представляется нам наиболее обоснованной.
В основе теории лежат расчеты энергии, необходимой для образования водной поры в липидном бислое. При этом могут встретиться три случая.
Случай 1. Везикулярная мембрана в отсутствие электрического поля
Представим себе мембрану, которая образует везикулу определенного размера и имеет, таким образом, определенную площадь поверхности. Заметим, что появление поры в данном случае не приводит к изменению площади поверхности липидного слоя мембраны.
На границе поверхности раздела липид/вода действуют силы поверхностного натяжения, которые сжимают мембрану. Наличие поверхностного натяжения приводит к тому, что образование водной поры в мембране сопровождается увеличением энергии системы (см. рис.4).
Для везикулярных структур при постоянстве площади поверхности липидного слоя и в отсутствие электрического поля работа по созданию поры сводится к работе по преодолению силы поверхностного натяжения на новообразованной границе: внутренняя поверхность поры/водный раствор. Таким образом, энергия образования поры, очевидно, равна произведению внутренней поверхности поры S = 2prh на удельную поверхностную энергию sp (заметим, что размерности удельной поверхностной энергии (Дж/м2) и поверхностного натяжения (Н/м) совпадают, поэтому обе величины мы обозначаем одной и той же буквой s, поскольку они равны друг другу как численно, так и по размерности):
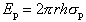 |
(1) |
В данном случае с ростом поры энергия системы монотонно растет пропорционально радиусу поры.
Случай 2. Плоская мембрана в отсутствие электрического поля
В случае плоских мембран с фиксированной поверхностью (таких как БЛМ) появление поры сопровождается возрастанием границы раздела за счет внутренней части поры, но уменьшением границы на поверхности мембраны. Последнее само по себе приводит к снижению энергии системы на величину 2 x pr2sm. Суммарное изменение энергии равно
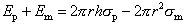 |
(2) |
График зависимости энергии системы от радиуса поры в этом случае выглядит как кривая с максимумом (см. рис.5).
Случай 3. Мембрана при наличии мембранного потенциала
При наличии внешнего электрического поля энергия системы описывается следующими уравнениями.
Для сферических мембран (везикулярные структуры):
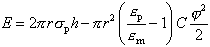 |
(3) |
Для плоских мембран (таких как БЛМ):
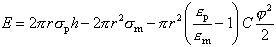 |
(4) |
где sm - поверхностное натяжение мембраны, sp - поверхностное натяжение боковой поверхности поры. em и ep – диэлектрические проницаемости вещества мембраны (углеводород) и поры (вода), соответственно.
В уравнениях (3) и (4) 2prsph – это работа, необходимая для образования водной поверхности по периметру поры; -2pr2sm – выигрыш в энергии за счет исчезновения мембраны в месте возникновения поры. Третий член уравнения появляется только в электрическом поле. Это выражение описывает изменение энергии системы при замене диэлектрика между обкладками конденсатора. Поскольку диэлектрическая проницаемость воды равна 80, а углеводородов 2, замена кусочка мембраны водной средой приводит к снижению энергии системы при наличии потенциала.
На рисунке 5 показана зависимость энергии системы от радиуса водной поры в мембране. Видно, что при увеличении радиуса энергия увеличивается, проходит через максимум, а затем начинает снижаться. Чем выше разность потенциала на мембране, тем меньше потенциальный барьер (E*), который должна преодолеть пора на пути к своему росту. Но после того как барьер преодолен, происходит самопроизвольный рост поры, т.е. "пробой" мембраны.
Ниже даны формулы критического радиуса r* и величины энергии активации E*.
Для упрощения введем подстановку:
Ec – электрическая составляющая энергии поры, приведенная к единице площади.
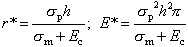 |
(5) |
В таблице 1 приведены величины критического радиуса поры и энергетического барьера для напряжений 0, 400 и 1000 мВ (для БЛМ из липидов мозга быка).
Таблица 1. Рассчитанные величины критического радиуса поры и энергетического барьера для плоских мембран при различных мембранных потенциалах
| Мембранный потенциал, мВ |
Критический радиус поры, Å |
Энергия активации пробоя, kT |
| 0 |
51 |
37 |
| 400 |
9 |
6 |
| 1000 |
2 |
1 |
В экспериментальных исследованиях группы Ю. А. Чизмаджева было показано, что при пробое образуются поры, для которых sm = sp. Это означает, что при появлении и росте пор у мембраны "хватает времени" на то, чтобы фосфолипидные молекулы проникли внутрь поры и выстлали ее поверхность (см. рис.6).
Самопробой БЛМ собственным диффузионным потенциалом
Электрический пробой мембран может играть какую бы то ни было роль в живой клетке, только если будет доказано, что пробой может происходить под влиянием собственного мембранного потенциала, т.е. разности потенциалов на мембране, которую сама мембрана генерирует в результате диффузии ионов. Опыт, который показывает, что такое бывает, приведен на рис.7. К раствору, омывающему БЛМ, добавляли переносчик протонов через мембрану (протонофор) ClCCP, а затем с одной стороны мембраны вводили немного кислоты, чтобы создать на мембране разность pH (DpH). На мембране возникал ионный диффузионный потенциал, величина которого при небольших DpH совпадала с теоретической величиной, рассчитанной по известному уравнению Нернста:
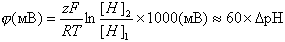 |
(6) |
Так при DpH = 1,2 теоретический потенциал должен быть 72 мВ, что близко к опытным данным (см. рис.7, снизу). Но при DpH = 3,2 теоретический потенциал 192 мВ не достигается. Когда потенциал немного не доходит до 140 мВ мембрану пробивает электрическим полем и измеряемый прибором потенциал падает.
При этом мембрана не разрушается механически, по крайней мере, некоторое время. Если осуществить "короткое замыкание" водных растворов по сторонам мембраны с помощью солевого мостика, потенциал сбрасывается и мембрана "самозалечивается" (см. рис.8). После удаления солевого мостика повторяется та же картина: быстро нарастает потенциал, который по достижении потенциала пробоя (около 140 мВ) падает и т. д. Опыт можно проделать два-три раза, пока мембрана, наконец, не разрушится.
Таким образом, мембрану может "пробивать" электрический потенциал, который она же и создает.
Потенциал пробоя фосфолипидных везикул (липосом)
Для создания потенциала на мембранах фосфолипидных везикул к суспензии липосом в незабуференном растворе сахарозы добавляли ацетат калия. Уксусная кислота в недиссоциированной форме проникает внутрь липосом, создавая на мембране разность концентраций ионов водорода (DpH). Эта разность концентраций препятствует дальнейшему вхождению ацетата, и липосомы сжимаются под влияние осмотического давления K+ и Ac– снаружи. Судить о таком сморщивании липосом можно по возрастанию светорассеяния (и уменьшению светопропускания) суспензии, как это видно на рис.9.
О наступлении пробоя можно судить по резкому скачку светопропускания суспензии (DT на рис.9), который связан с входом ацетата калия в липосому. Если отложить величину этого скачка светопропускания как функцию потенциала на мембране, рассчитанного по уравнению Нернста, то мы увидим отчетливый перелом на кривой, который соответствует потенциалу пробоя (см. рис.10).
Электрический пробой мембран эритроцитов
Эритроцит все же настоящая живая клетка, хоть и просто устроенная. Поэтому было интересно изучить явление пробоя эритроцитарной мембраны, как модели мембраны всякой другой клетки. Для создания мембранного потенциала достаточно изменять содержание хлоридов в окружающем растворе, поскольку мембрана эритроцита хорошо проницаема для ионов хлора и плохо – для катионов. Можно считать, что в изотоническом растворе сахароза + NaCl потенциал на мембране эритроцита – это потенциал Нернста для хлора, т.е.:
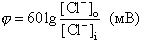 |
(7) |
С другой стороны, эритроцитарная мембрана хорошо проницаема также и для такого аниона как ион гидроксила. Поэтому создаваемый ионами хлора (которых много) мембранный потенциал приводит к перераспределению ионов водорода между эритроцитом и окружающим раствором. В незабуференной среде это перераспределение мало сказывается на pH раствора внутри клетки, где буферная емкость довольно высока, но приводит к изменениям pH окружающего раствора, таким что:
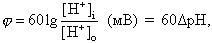 |
(8) |
где DpH – разность pH между окружающей средой и внутренним содержимым клетки. Таким образом, процедура создания и измерения мембранного потенциала у эритроцитов предельно проста: в незабуференный изотонический раствор сахарозы + NaCl при нейтральном pH впрыскивают небольшой объем отмытых эритроцитов и измеряют изменение pH раствора, которое принимается равным DpH в уравнении 8.
При постепенном снижении концентрации хлора происходит изменение потенциала, рассчитываемое по уравнению 8, практически равное теоретическому потенциалу, создаваемому ионами хлора (расчет по уравнению 7). Это видно на начальном участке графика на вкладке рис.11. Затем, однако, наступает перелом, и реальные потенциалы (рассчитанные по уравнению 7) оказываются ниже теоретических (уравнение 8). Это говорит о том, что кроме анионов, мембрана начала пропускать катионы и потенциал стал ниже теоретического потенциала Нернста. Кроме того, при таких потенциалах мембрана не держит потенциал: DpH снижается (кривые 5 – 8). Наконец, специальные опыты показали, что при таких высоких потенциалах происходит выход гемоглобина из эритроцитов. Все это позволяет думать, что при определенном потенциале (j* на рис.8) происходит электрический пробой мембран эритроцитов.
Электрический пробой внутренней мембраны митохондрий
Как известно, в присутствии субстратов энергии и кислорода происходит "энергизация" мембран митохондрий, которая заключается в создании разности электрохимических потенциалов протонов (DmH+) между водными фазами, разделенными внутренней мембраной. Суммарная величина DmH+ складывается из электрической и осмотической энергии протонов. В свою очередь, DmH+ создается за счет разности стандартных восстановительных потенциалов переносчиков электронов в точках сопряжения дыхательной цепи. Она была названа Митчеллом протон-движущей силой (PMF). Выраженная в милливольтах, протон-движущая сила дыхательной цепи, как уже говорилось в лекции 2, равна:
| PMF (мВ) = 60 (мВ) · DpH + Dj |
(9) |
Где DpH - разность pH, а Dj - разность потенциалов между водными фазами, разделенными внутренней мембраной митохондрий.
Чтобы выяснить, может ли разность потенциалов на внутренней мембране митохондрий вызвать электрический пробой этой мембраны, нам нужно, во-первых, научиться изменять потенциал Dj, а во-вторых, научиться его измерять. Начнем с первой задачи. Из уравнения 9 видно, что можно изменять мембранный потенциал Dj, если варьировать DpH. В свою очередь, довольно очевидно, что изменять DpH на мембране митохондрий можно, добавляя к этим органеллам анион, который проникает через мембрану в форме недиссоциированной кислоты, а затем, диссоциируя в матриксе митохондрий, нейтрализует щелочь, образовавшуюся при энергизации митохондрий, т.е., иначе говоря, снимает DpH. Таким анионом может служить ацетат, поскольку уксусная кислота легко проходит через фосфолипидный слой мембран. Добавляя к митохондриям разное количество ацетата, можно постепенно снижать DpH и, тем самым, дозировано увеличивать Dj.
С другой стороны, уже довольно давно известен метод измерения мембранного потенциала в митохондриях, основанный на измерении флуоресценции некоторых зондов, таких, например, как цианиновый краситель dis-S3(5), впервые примененный для этой цели Ларисом и сотрудниками в 1975 году. Будучи катионом, зонд входит внутрь митохондрий, где потенциал отрицательный, и там его флуоресценция тушится.
В наших исследованиях электрического пробоя мембран митохондрий, прежде всего, была проведена "калибровка" зонда. Для этого деэнергизованные митохондрии помещали в изотонические растворы, содержащие переносчик калия, антибиотик валиномицин, и разные концентрации ионов калия. Затем, измерив флуоресценцию dis-S3(5) во всех этих растворах, строили график зависимости флуоресценции зонда от рассчитанного по уравнению Нернста калиевого диффузионного потенциала. Получалась практически прямая линия. Этот график в последующих опытах был использован для расчетов мембранного потенциала в митохондриях, находящихся в различных состояниях, на основании измерения флуоресценции зонда dis-S3(5).
Результат одного из опытов показан на рис.12.
На рисунке хорошо видно, что при потенциале на мембране не выше 200 мВ этот потенциал стабилен, т.е. во времени не изменяется. Если же, добавив больше ацетата, создать еще более высокий (по абсолютной величине) потенциал на митохондриальной мембране, то возникший потенциал не держится, а начинает падать со скоростью, которую показывает tga на правой кривой рисунка 12. Зависимость tga от концентрации добавленного ацетата и мембранного потенциала показана на рисунке 13.
Как можно видеть на рис.13, при потенциале на мембране выше 200 мВ, по-видимому, наступает электрический пробой, что сопровождается падением мембранного потенциала и ростом флуоресценции зонда.
Снижение электрической прочности мембран при перекисном окислении липидов
На всех исследованных объектах (БЛМ, липосомы, эритроциты и митохондрии) было показано, что перекисное окисление липидов приводит к снижению потенциала пробоя, т.е. уменьшению электрической прочности (стабильности) липидного слоя мембран.
Некоторые экспериментальные данные, демонстрирующие этот вывод, приведены на рисунках 14 (a), 15 и 16.
Электрический пробой мембран – как универсальный механизм нарушения барьерной функции мембран в патологии
Ранее уже говорилось (см. лекцию 5), что существует всего четыре основных процесса, которые непосредственно обусловливают нарушение целостного липидного бислоя в патологии: (1) перекисное окисление липидов; (2) действие мембранных фосфолипаз; (3) механическое (осмотическое) растяжение мембраны и (4) адсорбция на бислое полиэлектролитов, включая некоторые белки и пептиды. Конечно, нас всегда волновал вопрос, почему такие разные по своей природе воздействия приводят к одному и тому же результату. Изучение влияния всех перечисленных факторов на потенциал пробоя мембран позволило пролить некоторый свет на эту проблему. Оказалось, что все они снижают потенциал пробоя, т.е. уменьшают электрическую прочность мембран. Это особенно четко было показано на простейшем объекте – БЛМ (см. рис.14). Отдельные опыты были поставлены и на других объектах. Так, например, на рис.17 можно видеть, что потенциал пробоя эритроцитов снижается при помещении клеток в гипотоническую среду, где их мембраны испытывают растяжение, вызванное осмотическим давлением изнутри.
Полученные данные позволяют предположить, что в живых клетках пробой мембран собственным мембранным потенциалом – одна из основных причин нарушения барьерной функции мембран в патологии. В самом деле, как видно из таблицы 2, потенциал пробоя митохондрий (200 мВ) всего на 25 мВ превышает ту разность потенциалов, которая в норме существует на внутренней мембране энергизованных митохондрий (175 мВ). Потенциал пробоя клеточной мембраны эритроцита всего на 20 – 30 мВ выше потенциала покоя в возбудимых клетках. Достаточно даже небольшого снижения электрической прочности (потенциала пробоя) мембраны под действием любого из четырех повреждающих факторов, чтобы потенциал пробоя сравнялся с существующим на мембране потенциалом, и тогда мембрана будет пробиваться разностью потенциалов, которую сама и создает.
Таблица 2. Электрические потенциалы (мВ) на мембранах клеток и потенциалы пробоя модельных и биологических мембран (А.В.Путвинский, Т.В.Пучкова, О.М.Парнев, Ю.А.Владимиров)
| Объект |
Разность потенциалов на мембране в клетках |
Потенциал пробоя |
| Липидный бислой |
– |
130 – 170
(БЛМ) |
| Клеточная мембрана |
70
(нервные и мышечные клетки) |
90 – 100
(эритроциты) |
| Внутренняя мембрана митохондрий |
175
(митохондрии печени в присутствии субстратов и кислорода)
| 200 |
Вопросы для самоконтроля и зачета
- Что такое электрический пробой мембраны?
- Расскажите о приготовлении БЛМ и о том, как была продемонстрирована возможность самопробоя мембраны ионным диффузионным потенциалом
- Как изучается пробой в липосомах?
- Как можно изучить явление электрического пробоя в эритроцитах?
- Изучение электрического пробоя в митохондриях
- Влияние перекисного окисления липидов и других повреждающих факторов на потенциал пробоя БЛМ.
ПОКАЗАТЬ ПЛАНПЕРЕЙТИ В НАЧАЛО